Ⅱ-2 乳癌領域
現在,以下に当てはまる乳癌患者に対しては,BRCA遺伝学的検査を行うことが推奨されている1)。一部,条件によっては保険適用となるものもあるため,治療選択を行う乳腺外来においても既往歴や家族歴等の情報は可能な限り確認することが求められる。
第一度近親者:同胞,両親,子,第二度近親者:おじおば,祖父母,おいめい,第三度近親者:いとこ,孫,大おじ大おば
従来は,本人の発症年齢だけではなく,血縁者のがん罹患状況から,遺伝性腫瘍の可能性が疑われた際には,遺伝診療部門において詳細な評価を開始していた。遺伝診療部門では詳細な家族歴の聴取,遺伝性腫瘍の可能性をアセスメントし,必要に応じてBRCA1/2をはじめとした遺伝性腫瘍の遺伝学的検査を提供していた。これまで提供されていた遺伝学的検査の多くは自費診療や研究として実施されていた。
国内ではPARP阻害薬の1つであるオラパリブが,2018年7月がん化学療法歴のあるBRCA病的バリアント保持かつHER2陰性の手術不能または再発乳癌に,2019年6月BRCA病的バリアント保持の卵巣癌における初回化学療法後の維持療法として保険適用になる際にBRCA1/2の遺伝学的検査もコンパニオン診断として保険収載された。さらに2020年4月には一定の条件を満たした乳癌,卵巣癌患者に対する遺伝性乳癌卵巣癌(hereditary breast and ovarian cancer:HBOC)診断を目的としたBRCA遺伝学的検査に保険適用が拡大,未発症の乳房や卵巣卵管を予防的に切除するリスク低減乳房切除術(risk reducing mastectomy:RRM)やリスク低減卵管卵巣摘出術(risk reducing salpingo‒oophorectomy:RRSO),健側・温存乳房に対する造影MRIサーベイランスも保険収載された。
わが国におけるHBOC診療体制が整っていくにつれ,これまで遺伝診療部門で主に担っていた検査前の面談や情報提供,検査後のサーベイランスやRRMやRRSOの意思決定支援に,がん診療に関わる診療科のスタッフも関わることになる。一方,こうした検査の情報が知られてきたことで,遺伝性のがんの可能性について気に掛ける乳癌患者も増えてきた。本BQにおいては,わが国の乳癌における遺伝学的検査の保険適用について解説をするが,乳癌患者の約2割2)が遺伝学的検査の結果,HBOCの背景があると判明しており,残りの約8割の乳癌患者は明確な遺伝性の背景がなくても罹患していることも留意されたい。どのような乳癌患者に遺伝学的検査を推奨すべきか,その背景について理解し,がん診療に関わる医療者が,適切な情報提供を行い,検査を選ぶ患者の意思決定支援に関わることで,術後のフォローや未発症の家族の検診につなげる必要がある。
BRCA遺伝学的検査を推奨される乳癌患者の臨床遺伝学的因子を以下にあげる。
HBOCは常染色体優性遺伝(autosomal dominant:AD)形式をとる遺伝性腫瘍である。遺伝子は両親から1つずつ引き継ぎ同じ遺伝子を1組もっている。遺伝子解析の結果病的バリアントを2つある片方の遺伝子上にもつヘテロザイゴート(Heterozygote)の場合,そのバリアントは両親のどちらかから来たと考える。BRCAに既知の病的バリアントをもつHBOCの家系員では発症・未発症にかかわらず,近親度に応じて同じ病的バリアントをもっている可能性がある。同じ病的バリアントをもつ可能性は,第一度近親者で1/2,第二度近親者で1/4,第三度近親者で1/8の確率である。そのため第一度,第二度,第三度近親者までにBRCA1/2の病的バリアントをもっている血縁者がいる場合には,HBOCの可能性を考慮し,遺伝学的検査の実施を検討する。
(1) 乳癌発症年齢
NCCNガイドラインでは2019年まで詳細な遺伝学的リスク評価を行うべき対象を提示していたが,2020年度版からこの項目が削除され,発症年齢の基準が50歳以下であったのが45歳以下に改訂されている1)。また日本人系統830家系の944名にBRCA1/2遺伝学的検査を実施したデータでは,127例がBRCA1に,115例がBRCA2に病的バリアントが検出されている2)。初発乳癌の発症年齢に関してBRCA1病的バリアント保持者とBRCA2病的バリアント保持者間には有意な差はなかったが,HBOC(BRCA1/2病的バリアント保持群)とBRCA1/2陰性群の平均発症年齢は,それぞれBRCA140.2 歳(95%CI:38.15‒42.25),BRCA241.7 歳(95%CI:39.71‒43.70),陰性45.4 歳(95%CI:44.54‒46.26)であった。BRCA1病的バリアント保持群の乳癌発症年齢は,BRCA陰性群に比べて有意に低く(P<0.001),またBRCA2病的バリアント保持群とBRCA陰性群の間にも有意な差があった(P=0.004)2)。
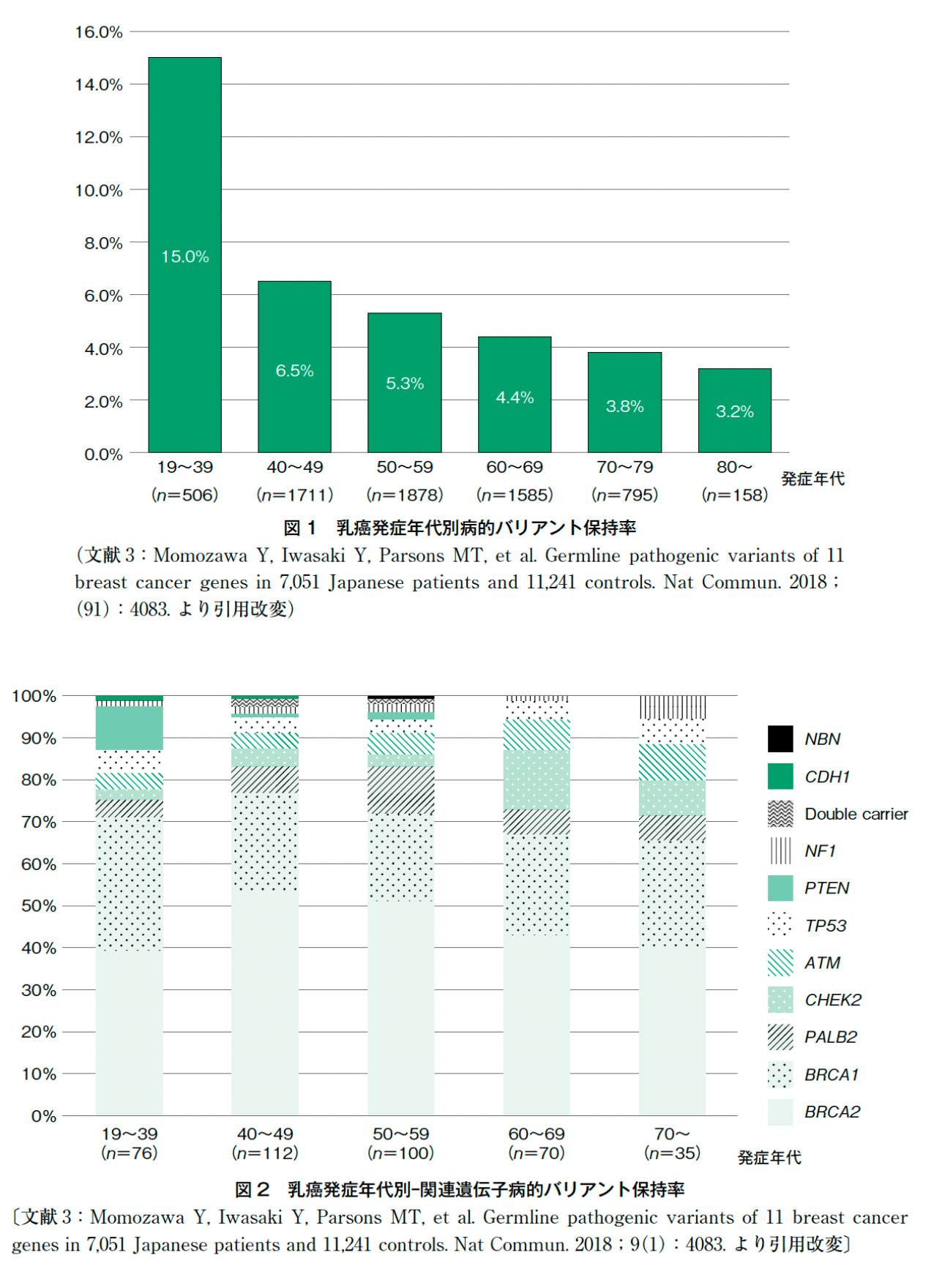
2018年にMomozawaらが行った解析では,日本人の7,051人の乳癌女性と家族歴のない癌未発症の60歳以上の女性11,241人の対照群にBRCA1/2を含む乳癌関連11遺伝子(BRCA1,BRCA2,PALB2,TP53,PTEN,CHEK2,NF1,ATM,CDH1,NBN,STK11)のマルチ遺伝子パネル(multi—gene panel:MGP)検査を行った結果,病的バリアントを保持する割合は40歳未満で診断された集団の15.0%であり,診断時年齢が上がるにつれて有意に減少している(コクラン・アーミテージ検定,P=1.50×10-15)ものの,80歳以上で診断された乳癌患者の3.2%にも病的バリアントがあることが報告された(図1)。また70 歳以上の病的バリアントが見つかった乳癌患者のうち約65%がBRCA1/2に病的バリアントをもっていた(図2)3)。
(2) サブタイプ
BRCA1/2に病的バリアントを保持する乳癌の特徴として,BRCA1病的バリアント保持者のうち75.8%がトリプルネガティブタイプの乳癌(triple—negative breast cancer:TNBC)で,21.2%がLuminal タイプ,HER2 タイプが2%,BRCA2病的バリアント保持者では,TNBC は18.6%,Luminal タイプは64.4%と報告がある2)。
(3) 性別(男性乳癌)
Momozawaらの研究では,男性乳癌症例53例,一般男性の対照者12,490例についても比較解析を行なっており,53例中13例(24.5%)の男性乳癌患者と12,490例中129例(1.0%)の男性対照者において,BRCA1/2を含む乳癌関連遺伝子の病的バリアントを75同定している(フィッシャーの厳密検定,P=1.64×10-14,OR=31.1)。女性乳癌患者と比較すると男性乳癌患者の病的バリアントの頻度は有意に高く(フィッシャーの厳密検定,P=7.93×10-6,OR=5.3),特にBRCA2の病的バリアントの保持率は男性乳癌と有意に関連していた(症例では18.9%,対照群では0.2%,フィッシャーの厳密検定,P=1.73×10-16,OR=111.2)。乳癌診断時年齢を,BRCA2に病的バリアントをもつ男性乳癌患者と病的バリアントをもたない患者とで比較すると,病的バリアントをもつ患者のほうが,病的バリアントをもたない患者よりも乳癌診断時年齢が有意に高かった(平均±SD,75.5±5.8 歳)(63.3±10.6 歳,t 検定,P=3.90×10-5)3)。
(4) 2個以上の原発乳癌
BRCA1/2の病的バリアント保持者の2個以上の原発乳癌患者の病的バリアント保持率はBRCA1に病的バリアントを保持する集団で40%,BRCA2に病的バリアントを保持する集団で18%のと報告がある2)。
Momozawaらの研究では,BRCAに病的バリアントをもつ乳癌患者は男性,女性の双方の家族歴において,第二度近親者までに,乳癌(両側乳癌,進行期乳癌,トリプルネガティブ乳癌),卵巣癌,膵癌,胃癌,肝癌,骨癌,膀胱癌の家族歴がそれぞれ高かったことを示している3)。
本人の既往歴が条件に合致しない場合でも,第三度近親者までの家族歴は簡易的にでも確認できるような問診票等を外来で利用することも検討する。こうした血縁者の情報は,外来の初診時には明確に思い出せないことも多い。また家族歴は時間の経過とともに変わっていくため,見直されることが理想である。患者が術後のフォローで受診する際や,二次原発性乳癌を発症した場合等,家族の癌罹患歴も合わせて更新できれば,想定される遺伝性腫瘍の可能性にも変更が生じ,遺伝学的検査を再検討される必要が出てくる。遺伝診療部門の介入や外来における定期的な家族歴の更新は可能な限り実践されたい。
本人発症年齢や家族歴が条件を満たさない場合でもPARP阻害薬のコンパニオン診断として,BRCA遺伝学的検査を実施することがある。PARP阻害薬の1つ,オラパリブはがん化学療法歴のあるBRCA病的バリアント保持かつHER2陰性の手術不能または再発乳癌の場合に保険適用される。コンパニオン診断としての遺伝学的検査の時期については,転移性乳癌の治療歴や本人の体調等から考慮すべきである。また,転移性前立腺癌や膵癌でもPARP阻害薬のコンパニオン診断として,BRCA遺伝学的検査が利用される可能性がある。
コンパニオン診断としてBRCA遺伝学的検査を実施する場合には,治療に影響する側面以外に,遺伝性腫瘍としてのサーベイランスや血縁者への影響についても可能な限り説明や資料を用意することや遺伝診療部門への連携ができるような体制で実施することが望ましい。
次世代シーケンサー(next generation sequencer:NGS)を用いたがんゲノムプロファイリング検査は治療方針の策定の補助に資する遺伝子変異の情報を出力するため主には腫瘍組織を用いて数百にわたるがん関連遺伝子のゲノム情報を解析する。腫瘍組織には,後天的に生じたバリアントが多く存在しているが,バリアントの保持率によっては,生殖細胞系列として生まれ持ったバリアントを保持していることが示唆されることもある。またがんゲノムプロファイリング検査によっては,比較解析のために採血等で得た生殖細胞系列の細胞も解析しているものもある。それぞれのがんゲノムプロファイリング検査の特徴を捉えたうえでの検査の実施,またがんゲノムプロファイリング検査を介して得られたバリアント情報の取り扱いについては,「ゲノム医療における情報伝達プロセスに関する提言(改訂第2 版)」4)も参照されたい。BRCA1およびBRCA2についてはがんゲノムプロファイリング検査でバリアントが疑われた場合,生殖細胞系列での遺伝学的検査が推奨されている。再確認のための遺伝学的検査については,検査実施体制,遺伝診療部門へ紹介できるような連携体制を構築しておくことが望ましい。
遺伝性腫瘍の特徴として,血縁者が同様の易罹患性をもっている場合でも浸透率の個人差や家系内の男女比や同胞数といった要素が影響し,見かけ上がん患者はいないと評価される場合もある。または核家族化や居住地域のばらつきから家族が一同に介して情報共有する機会は減っていくと考えられ,実際には罹患している家族がいる場合でも,本人にとっては不明,あるいはがんの家族歴がないと認識されている可能性がある(養子縁組等で生物学上の血縁者の情報がないといったケースもある)。これまであげたような条件に合致しない場合でも,がん患者が検査についての情報を知りたいと希望する場合には,遺伝診療部門への紹介をできるような体制づくりが望まれる。
BRCA,breast cancer,genetic test,cost,patient preference
