-
1背景
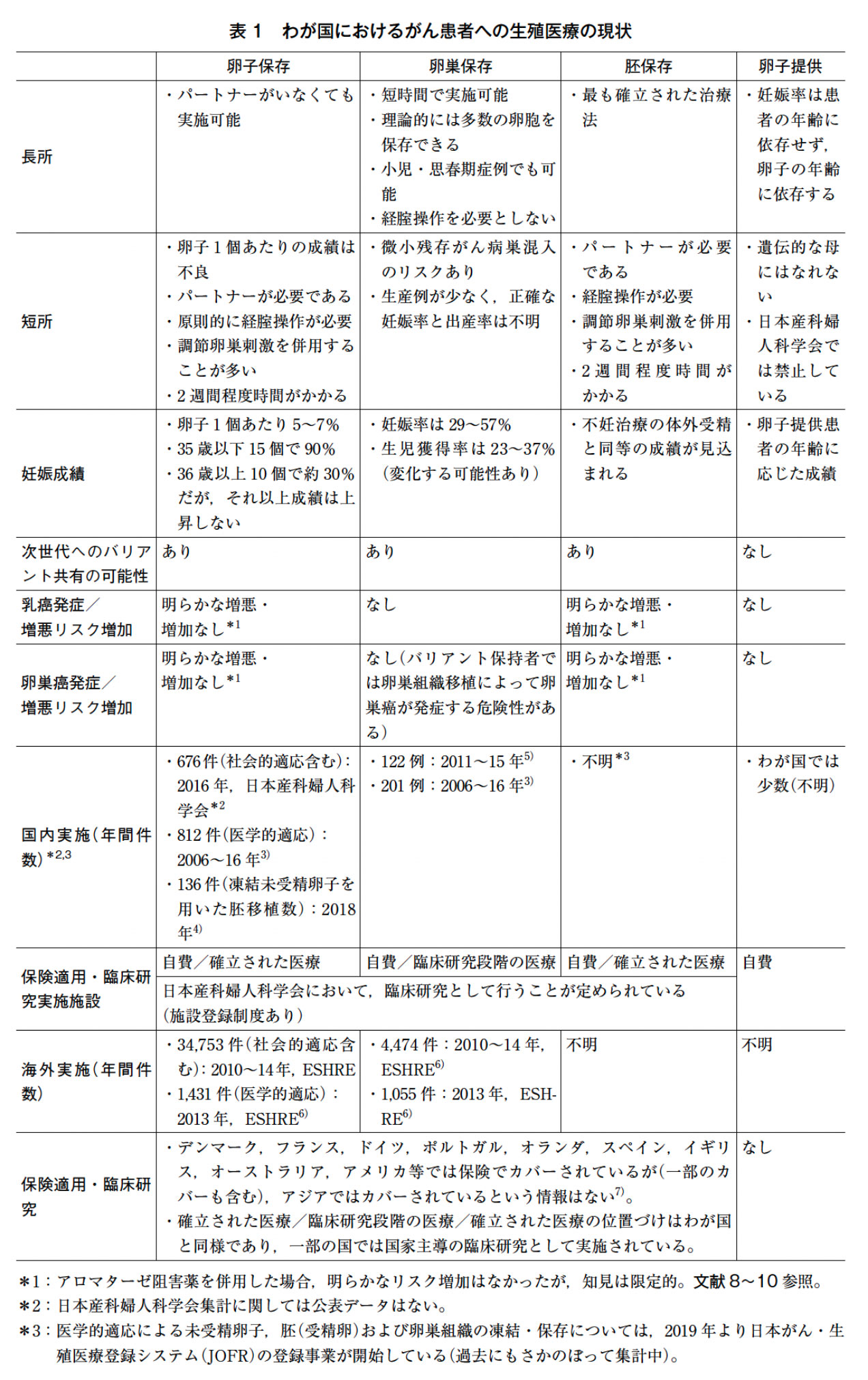
近年の生殖補助医療の発達により,わが国の体外受精・顕微授精による児の出生は16人に1人(2018年)となり,生殖補助医療による妊娠は以前よりも一般的になってきた。また,従来の不妊治療で行われていた胚(受精卵)の凍結保存以外に,卵子(未受精卵)ならびに卵巣組織の凍結も実施可能となってきている(詳細は「背景」の終わりで述べる)。現時点において,胚凍結と卵子凍結は“確立された治療法”とされており,卵巣組織凍結は“臨床研究段階の治療法”とされている。胚凍結はパートナーをもつ成人期以降の患者に対して行われるものであるが,パートナーのない若年者の場合等は卵子凍結が実施される。卵巣組織凍結に関しては,主に治療により妊孕性が低下/喪失することが予想される疾患がすでに発症しており,その治療開始までに猶予期間が全くない場合や経腟的操作のできない小児・思春期症例に対して適応される。なお,卵巣組織凍結による初の生児獲得の海外報告は2004年であるが,それ以降130人以上の生産例の報告があり,児の異常発生率に関しても総集団における頻度と明らかな差がないと推測されている。
わが国においても,これら適応疾患をもつ患者に対する妊孕性温存療法は普及の一途を辿っており,主に日本産科婦人科学会において「医学的適応による未受精卵子,胚(受精卵)および卵巣組織の凍結・保存に関する登録施設」として認可された施設で実施されている1)。また,これらの妊孕性温存療法の均てん化を目的として,日本癌治療学会から『小児,思春期・若年がん患者の妊孕性温存に関する診療ガイドライン2017年版』2)が刊行され,本医療の安全性の確保と普及に寄与している。さらに2019年より,日本がん・生殖医療学会の事業として,オンンラインレジストリ「日本がん・生殖医療登録システム(Japan Oncofertility Registry:JOFR)」が開始され,わが国での妊孕性温存療法の情報収集が本格化されている(表1)。
このような背景をもとに,すでに乳癌を発症したBRCA1/2病的バリアントの保持者に対する妊孕性温存療法は,わが国においてもある一定数実施されていることが推察される。しかしながら,乳癌患者におけるBRCA1/2病的バリアントの検索が完全に行われていないことから,その実数は不明である。
また,このような生殖補助医療の過程において,BRCA1/2病的バリアントに対する着床前診断の選択も技術的には可能となっている。しかし,わが国における単一遺伝子疾患を対象としたPGT—Mは,「成人に達する以前に日常生活を強く損なう状態が発現したり生存が危ぶまれる疾患」を“重篤”であるとして日本産科婦人科学会で承認してきた経緯がある11)。よって,2020年12月現在,成人発症疾患であるHBOCはこれに該当しないため適応とはなっていない。一方,海外の一部の国(米国,英国,独国,仏国,蘭国等)では,成人発症の単一遺伝性疾患に対する着床前診断も“生殖における自由”として倫理的に許容されているが,複数施設での倫理委員会で承認されていることや,公的な委員会等で“重篤”な疾患であると認められていること等が条件となっている国もある。しかし,米国小児科学会等の一部の団体は,予防的介入医療がない成人発症疾患に対する児(胚)の遺伝子診断に対し,児の「遺伝情報から自由でいる権利」の侵害であり不適切だとして反対している。このような海外の状況も踏まえ,前述の“重篤性の解釈”については,改めて現在のわが国における社会倫理観も鑑み,日本産科婦人科学会を含めた有識者においてその解釈に再審議が行われているところである。
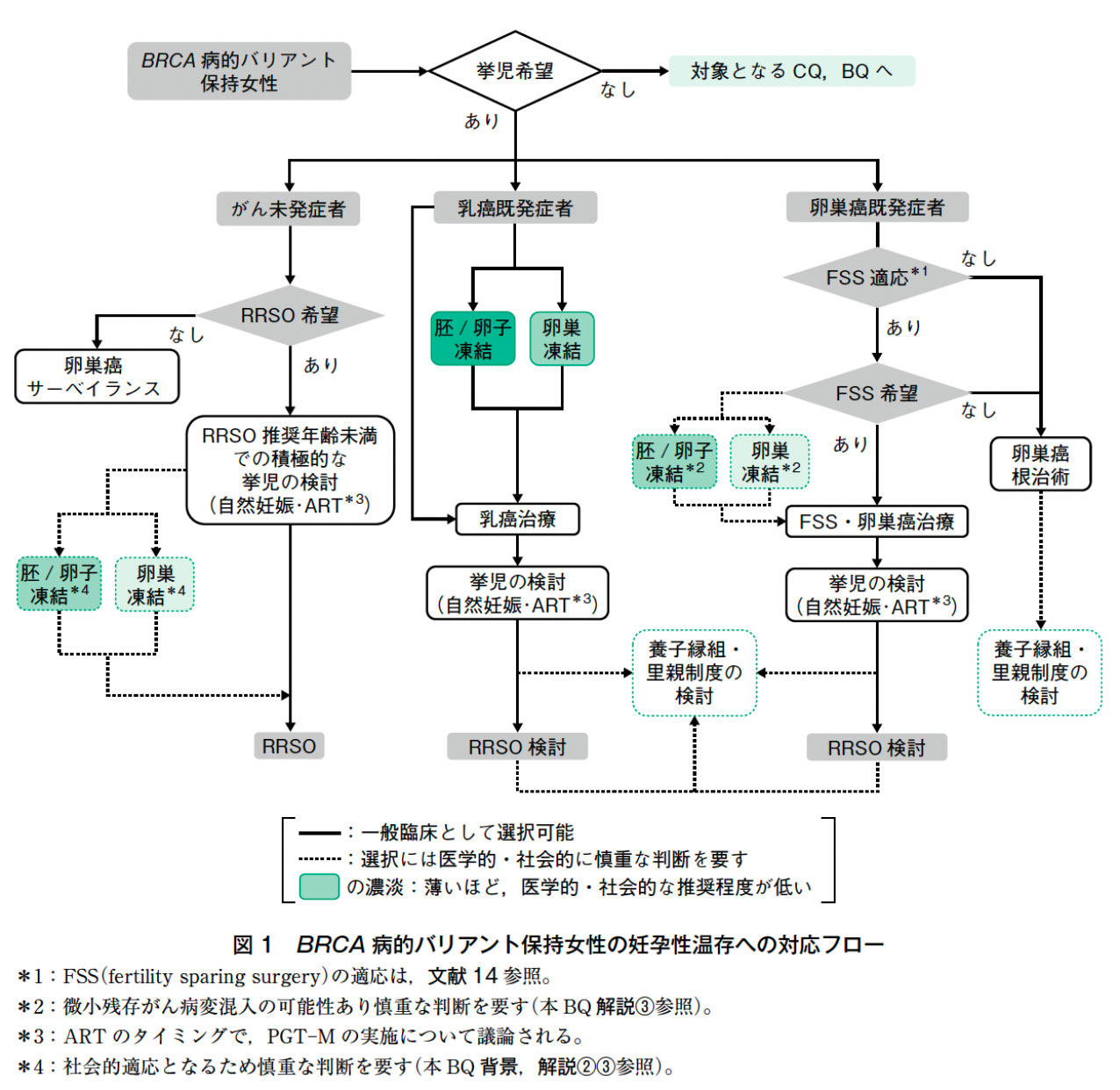
日本産科婦人科学会では,『医学的適応』による未受精卵子(以下卵子という),胚(受精卵,以下胚という)および卵巣組織の凍結・保存として,悪性腫瘍等(以下,原疾患)に罹患した女性に対し,原疾患の治療(外科的療法,化学療法,放射線療法等)によって卵巣機能が低下し,妊孕性が失われると予測される場合,妊孕性を温存する方法として,卵子または胚を凍結・保存することを承認している(2018年6月承認,2019年4月最終細則変更)12)。一方,それ以外の事由による卵子や胚の凍結は『社会的適応』とされ,推奨しない立場をとっている。日本生殖医学会においても,医学的介入による妊孕性低下に対し,同様に『医学的適応』による卵子または胚の凍結について承認しており13),『社会的適応』については『医学的適応のない』という言葉を併用した指針が示され,一定の条件下のもと実施することが容認されている。本稿における卵子・胚凍結に関しては様々なシナリオ(図1)があり,乳癌既発症者で化学療法前のケースでは上記の『医学的適応』に該当すると考えられるが,BRCA1/2病的バリアント保持者であるということのみでは,厳密には日本産科婦人科学会の定義する『医学的適応』の要件を満たさず,『社会的適応』もしくは『医学的適応のない(日本生殖医学会)』卵子・胚凍結に該当する可能性が排除できず,少なくとも現時点では推奨されない。
-
2解説
❶ BRCA1/2病的バリアント保持者に対する胚・卵子凍結の安全性
胚・卵子凍結を実施する際,一度の周期で効率的に卵子を採取することを目的として,一般的には卵胞刺激ホルモン製剤等を用いた調節卵巣刺激(controlled ovarian stimulation:COS)を行う。その際,発育した卵胞から分泌されるエストラジオールや,採卵後に分泌されるプロゲステロン等が分泌されることから,特に乳癌患者において疾患が増悪する可能性が懸念されている。現在は,乳癌患者におけるエストラジオール値の上昇を抑制する目的にアロマターゼ阻害薬であるレトロゾールを併用したCOS が一般化しつつある。現時点では,アロマターゼ阻害薬併用のCOSによって胚・卵子凍結を実施した際,明らかな乳癌ならびに卵巣癌の発症リスク上昇や再発率の上昇は認められていない。ただし,そのエビデンスは限定的である8)~10)。
❷ BRCA1/2病的バリアント保持者に対する胚・卵子凍結の有効性
胚・卵子凍結に関して,BRCA1/2病的バリアント保持者では,複数のシステマティックレビューと臨床研究において卵巣予備能低下(卵胞数の減少)による採卵数ならびに凍結卵子数の低下が示唆されている15)~19)。そのため,BRCA1/2病的バリアント保持者では,遺伝カウンセリングとともに,生殖医療の専門家による正確な卵巣予備能評価と早期介入が必要とされている。しかしながら,本知見を否定する報告もあり20)21),一定の見解は得られていない。
❸ BRCA1/2病的バリアント保持者に対する卵巣組織凍結
現時点においては,BRCA1/2病的バリアント保持者における卵巣組織凍結保存・移植に関する安全性と有効性の報告はない。しかしながら,BRCA1/2病的バリアント保持者では,卵巣組織移植は潜在的に卵巣癌発生のリスクをもつことから,一般の乳癌患者の症例と比べても,反対する意見が多いとの報告もある22)。今後,慎重な議論の必要な領域と考えられる。また,卵巣組織凍結では,すべての症例において卵巣組織内に悪性病変が存在する可能性が否定できず(微小残存がん病巣),なかでも卵巣癌患者の場合にはそのリスクが高いことが指摘されている。そのため,特に卵巣癌既発症者で妊孕性温存を目的とした縮小手術(fertility sparing surgery:FSS)前の患者においては,微小残存がん病巣のハイリスクと考えられるため,卵子・胚凍結ならびに卵巣組織凍結ともにリスクの高い治療と言わざるを得ない。なお,欧州ヒト生殖発生医学会(The European Society of Human Reproduction and Embryology:ESHRE)の最新のガイドラインでは,BRCA病的バリアント保持女性における凍結卵巣組織移植を“弱い推奨”に位置付けており,胚・卵子凍結が不可能であった場合にのみ,妊娠・出産後に卵巣組織を完全に摘出除去することを条件として許容する姿勢を示している23)。
❹ BRCA1/2病的バリアント保持者におけるPGT—M希望
米国ではHBOCを含めた,生命を脅かす疾患を成人期に生じ得る場合のPGT—Mについても倫理的に正当化され得る,という見解がある他24),欧州においても,各国の基準に基づいて成人期発症疾患に対するPGT—Mが実施されている25)。そのような現状において,BRCA1/2遺伝子の病的バリアント保持者を対象とした欧米における横断研究では,BRCA1/2病的バリアント保持者のPGT—Mの認知率は6~7割で,PGT—M受検希望は,2~4割であった26)~30)。なお,わが国のBRCA1/2病的バリアント保持者におけるPGT—M希望に対する意識調査のデータはない。
❺ BRCA1/2病的バリアント保持者におけるPGT—Mの生児獲得
6名の乳癌既発症者を含む,70組のBRCA1/2病的バリアント保持者カップル(うち男性病的バリアント保持28組)において,145周期(うち3周期は保存卵子)に対しPGT—Mを実施したベルギーとオランダにおけるコホート研究では,親と同じ病的バリアントを有さない294胚(/720胚,40.8%)を得て36名が出産に至った。妊娠後,未発症であったBRCA1病的バリアント保持女性36名のうち2名が乳癌を発症した。よって,未発症保持者を対象としたPGT—M後の生児獲得割合は良好(33/64組,52%)であるが,がんの既発症者を対象とした実施例の報告はいまだ少ないのが現状である。
-
3キーワード
fertility preservation,oocyte cryopreservation,ovarian tissue cryopreservation,pre—implantation genetic testing for monogenic disorders;PGT—M
-
4参考文献
- 1) 日本産婦人科学会.施設一覧.
http://www.jsog.or.jp/facility_program/search_result_facility.php
- 2) 日本癌治療学会.小児,思春期・若年がん患者の妊孕性温存に関する診療ガイドライン2017年版.金原出版,2017.
- 3) 鈴木 直(研究代表).厚生労働省子ども・子育て支援推進調査研究事業「若年がん患者に対するがん・生殖医療(妊孕性温存治療)の有効性に関する調査研究 平成28 年度」総括・分担報告書.
- 4) 日本産科婦人科学会.ARTオンライン登録.
https://plaza.umin.ac.jp/~jsog—art/
- 5) 大須賀 穣(研究代表).日本医療研究開発機構(AMED)委託研究.「生殖機能温存がん治療法の革新的発展にむけた総合的プラットフォームの形成」成果報告書.
https://amedfind.amed.go.jp/amed/search/task_search_details.html
- 6) ESHRE Working Group on Oocyte Cryopreservation in Europe, Shenfield F, de Mouzon J, et al. Oocyte and ovarian tissue cryopreservation in European countries:statutory background, practice, storage and use. Hum Reprod Open. 2017(1):hox003.[PMID:30895222]
- 7) Rashedi AS, de Roo SF, Ataman LM, et al. Survey of Fertility Preservation Options Available to Patients With Cancer Around the Globe. JCO Glob Oncol. 2020;6.[PMID:32259160]
- 8) Chen LM, Blank SV, Burton E, et al. Reproductive and hormonal considerations in women at increased risk for hereditary gynecologic cancers:Society of Gynecologic Oncology and American Society for Reproductive Medicine Evidence—Based Review. Fertil Steril. 2019;112(6):1034—42.[PMID:31606136]
- 9) Huber D, Seitz S, Kast K, et al. Use of fertility treatments in BRCA1/2 mutation carriers and risk for ovarian and breast cancer:a systematic review. Arch Gynecol Obstet. 2020;302(3):715—20.[PMID:32719921]
- 10) Kim J, Turan V, Oktay K. Long—term safety of Letrozole and Gonadotropin stimulation for fertility preservation in women with breast cancer. J Clin Endocrinol Metab. 2016;101(4):1364—71. [PMID:26751194]
- 11) 日本産婦人科学会.倫理委員会議事録.平成16年度.2004年6月18日
http://www.jsog.or.jp/jsog_web/html/committee/ethical/pdf/rinri_gijiroku16_01.pdf
- 12) 日本産婦人科学会.医学的適応による未受精卵子,胚(受精卵)および卵巣組織の凍結・保存に関する見解.2019年3月.
http://www.jsog.or.jp/modules/statement/index.php?content_id=23
- 13) 日本生殖医学会倫理委員会.未受精卵子および卵巣組織の凍結・保存に関する指針.2018年3月.
http://www.jsrm.or.jp/guideline—statem/guideline_2018_01.html
- 14) 日本婦人科腫瘍学会 編.CQ 06 妊孕性温存を希望する患者に,温存治療は奨められるか? 卵巣がん・卵管癌・腹膜癌治療ガイドライン2020年度版 第5版,金原出版,pp81—83,2020.
- 15) Oktay K, Turan V, Titus S, et al. BRCA mutations, DNA repair deficiency, and ovarian aging. Biol Reprod. 2015;93(3):67.[PMID:26224004]
- 16) de la Noval BD. Potential implications on female fertility and reproductive lifespan in BRCA germline mutation women. Arch Gynecol Obstet. 2016;294(5):1099—103.[PMID:27561295]
- 17) Turan V, Bedoschi G, Emirdar V, et al. Ovarian stimulation in patients with cancer:impact of Letrozole and BRCA mutations on fertility preservation cycle outcomes. Reprod Sci. 2018;25(1):26—32.[PMID:28874104]
- 18) Turan V, Oktay K. BRCA—related ATM—mediated DNA double—strand break repair and ovarian aging. Hum Reprod Update. 2020;26(1):43—57.[PMID:31822904]
- 19) Porcu E, Cillo GM, Cipriani L, et al. Impact of BRCA1 and BRCA2 mutations on ovarian reserve and fertility preservation outcomes in young women with breast cancer. J Assist Reprod Genet. 2020;37(3):709—15.[PMID:31872386]
- 20) Gunnala V, Fields J, Irani M, et al. BRCA carriers have similar reproductive potential at baseline to noncarriers:comparisons in cancer and cancer—free cohorts undergoing fertility preservation. Fertil Steril. 2019;111(2):363—371.[PMID:30527950]
- 21) Grynberg M, Dagher Hayeck B, et al. BRCA1/2 gene mutations do not affect the capacity of oocytes from breast cancer candidates for fertility preservation to mature in vitro. Hum Reprod. 2019;34(2):374—79.[PMID:30561604]
- 22) Lambertini M, Di Maio M, Poggio F, et al. Knowledge, attitudes and practice of physicians towards fertility and pregnancy-related issues in young BRCA-mutated breast cancer patients. Reprod Biomed Online. 2019;38(5):835—44.[PMID:30914152]
- 23) Anderson RA, Amant F, Braat D, et al;ESHRE Guideline Group on Female Fertility Preservation. ESHRE guideline:female fertility preservation. Hum Reprod Open. 2020;2020(4):hoaa052. [PMID:33225079]
- 24) Ethics Committee of the American Society for Reproductive Medicine. Electronic address:ASRM@asrm.org;Ethics Committee of the American Society for Reproductive Medicine. Use of preimplantation genetic testing for monogenic defects(PGT—M)for adult—onset conditions:an Ethics Committee opinion. Fertil Steril. 2018;109(6):989—92.[PMID:29935659]
- 25) Dondorp W, de Wert G. Refining the ethics of preimplantation genetic diagnosis:A plea for contextualized proportionality. Bioethics. 2019;33(2):294—301.[PMID:30474145]
- 26) Mor P, Brennenstuhl S, Metcalfe KA. Uptake of Preimplantation Genetic Diagnosis in Female BRCA1 and BRCA2 Mutation Carriers. J Genet Couns. 2018;27(6):1386—94.[PMID:29858758]
- 27) Gietel—Habets JJ, de Die—Smulders CE, Derks—Smeets IA, et al. Awareness and attitude regarding reproductive options of persons carrying a BRCA mutation and their partners. Hum Reprod. 2017;32(3):588—97.[PMID:28073972]
- 28) Rich TA, Liu M, Etzel CJ, et al. Comparison of attitudes regarding preimplantation genetic diagnosis among patients with hereditary cancer syndromes. Fam Cancer. 2014;13(2):291—9.[PMID:24072553]
- 29) Julian—Reynier C, Fabre R, Coupier I, et al. BRCA1/2 carriers:their childbearing plans and theoretical intentions about having preimplantation genetic diagnosis and prenatal diagnosis. Genet Med. 2012;14(5):527—34.[PMID:22241105]
- 30) Quinn GP, Vadaparampil ST, Miree CA, et al. High risk men’s perceptions of pre—implantation genetic diagnosis for hereditary breast and ovarian cancer. Hum Reprod. 2010;25(10):2543—50.[PMID:20713415]