Ⅱ-4 前立腺癌領域
BRCA生殖細胞系列病的バリアントを伴う前立腺癌はバリアントを有さない症例に比して,予後不良とされる。早期発見例では監視療法を行うことなく,積極的な治療介入が望まれる。新規内分泌療法後の転移を有する症例に対して,PARP阻害薬が有効である。
一般的に限局性前立腺癌に対する根治療法としての標準治療は,手術療法もしくは放射線療法が選択される。また一定の条件を満たす場合は,超低リスク群と定義され,すぐには治療介入しない監視療法もわが国において近年選択される傾向がある。しかし,BRCA病的バリアントを有する前立腺癌はBRCA病的バリアントをもたない前立腺癌と比較して,監視療法を選択した場合の進行が早いことから,注意が必要である。
転移性前立腺癌に対して,新規内分泌療法・タキサン系抗がん剤・アルファ線放出放射線性医薬品が開発され,予後の改善に貢献してきた1)。BRCA1あるいはBRCA2あるいはATMの病的バリアント(遺伝的病的バリアントもしくは,腫瘍組織での体細胞病的バリアント)を有するアンドロゲン受容体シグナル阻害薬であるエンザルタミドやアビラテロンに抵抗性の前立腺癌を対象とした第Ⅲ相臨床試験でPARP阻害薬は有効性を示し,わが国において保険収載された2)。BRCA病的バリアントを有する前立腺癌に対する治療選択肢の1つとなる。しかし,一方で新規内分泌療法・タキサン系抗がん剤等の有効性については十分な検討がされていない。今後の大規模なコホートでPARP阻害薬を含む併用療法など,前向きな検証が待たれる。
BRCA病的バリアントを有する男性は一般的な男性と比べて前立腺癌を発症するリスクが高く,とりわけBRCA2の病的バリアントを有する場合は高リスク前立腺癌を認めることが多い3)。BRCA1あるいはBRCA2の病的バリアントを有する男性における前向きコホート研究では,BRCA1病的バリアント保持者376例中16例に,BRCA2病的バリアント保持者447例中26例に前立腺癌が発生し,同国内の一般集団における前立腺癌発生頻度のそれぞれ2.35倍と4.45倍であった。とりわけBRCA2病的バリアント保持者の男性においてグリソンスコア7以上は一般集団の5.07倍であった3)。転移性去勢抵抗性前立腺癌(mCRPC)419例を対象とした前向きコホート研究ではBRCA2病的バリアント保持者は独立した予後不良因子であった4)。またmCRPC222例を対象としたエンザルタミドvs.アビラテロンのランダム割り付け比較試験では,サブグループ解析として循環腫瘍DNA(circulating tumor DNA:ctDNA)中のBRCA2あるいはATMの病的バリアント(この場合,生殖細胞系列病的バリアントと体細胞病的バリアントの両方を含む)の有無で無増悪生存期間が評価され,BRCA2あるいはATMの病的バリアントは有意な予後不良因子であった5)。BRCA病的バリアントを有する男性に生じた前立腺癌は通常の前立腺癌とは異なることを認識する必要がある。
腫瘍マーカーPSAが10ng/mL以下・臨床病期が前立腺の一部に限局する腫瘍量の小さいT2a未満・生検の陽性コア数2本以下・病理診断でのグリソンスコアが6以下などの一定の条件を満たす場合は,超低リスク群と定義され,生命予後に影響しない症例群が潜んでいると考えられ,すぐには治療介入しない監視療法もわが国において近年選択される傾向がある。監視療法はまだ研究の途上で経過観察方法が確立されているとは言い難いが,定期的にPSA定量やMRIによる画像診断,ならびに一定の期間の後の再度の生検により監視し,悪性度が進行した際に治療介入を推奨する方法である。中リスクまでの前立腺癌に対して監視療法を選択した米国のコホート(集団)において,生殖細胞系列にDNA 修復遺伝子(BRCA1/2およびATM)の病的バリアントを認める前立腺癌は,病的バリアントを認めない前立腺癌と比較して1.96倍と有意なグリソンスコアの上昇を認めた(P=0.04)6)。これらの結果は,早期発見例では監視療法ではなく積極的な治療介入が必要であることを示唆する。
BRCA病的バリアントを有する転移性前立腺癌に対しては,PARP阻害薬の有効性がPROfound試験において報告されている。PROfound試験は,FoundationOne CDxがんゲノムプロファイルによる腫瘍組織におけるDNA修復経路(DNA damage response:DDR)関連遺伝子病的バリアントを有する,エンザルタミドまたはアビラテロン加療後のmCRPC患者を対象とし,PARP阻害薬オラパリブの有効性を検証した試験である。オラパリブ群は,エンザルタミド(アビラテロン既治療)またはアビラテロン(エンザルタミド既治療)と比較して,主要評価項目であるBRCA1またはBRCA2またはATM 病的バリアント保持患者における画像診断に基づく無増悪生存期間(radiographic progression free survival:rPFS)の統計学的に有意かつ臨床的に意義ある延長が示された2)。DDRに関する生殖細胞系列病的バリアントを認めた前立腺癌61例のうち36例(59%)に対側遺伝子の体細胞病的バリアントあるいは欠失を認めたという報告7)から,生殖細胞系列でのBRCA1あるいはBRCA2の病的バリアントは組織におけるBRCA1あるいはBRCA2の機能低下を引き起こし,PARP阻害薬が効果を示すと考えられている。これらの試験を根拠にわが国でもアンドロゲン受容体シグナル阻害薬加療後のBRCA1あるいはBRCA2病的バリアントを有するmCRPCに対し2020年12月に承認された。今後わが国における実臨床での使用成績の集積が待たれる。
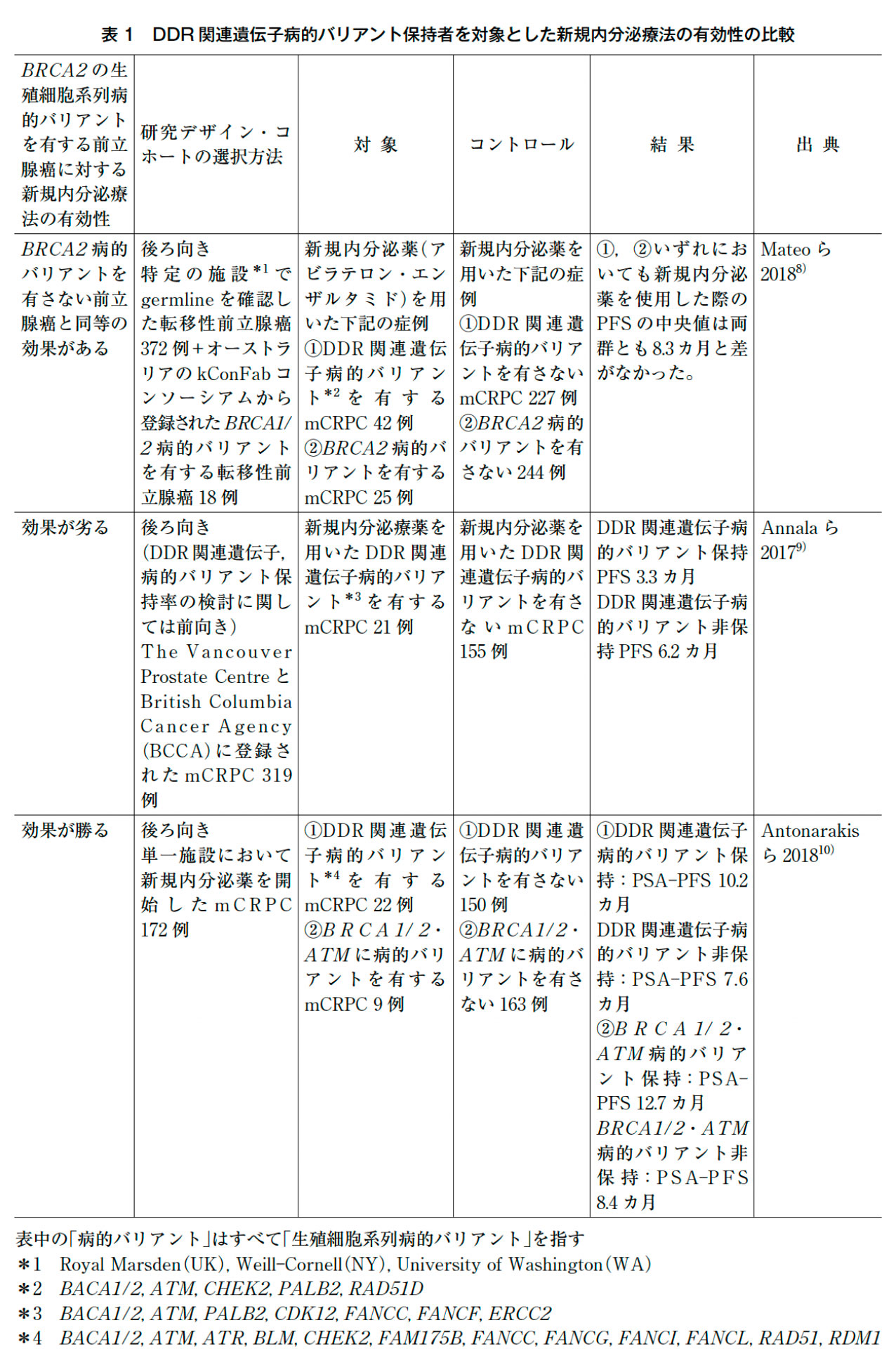
転移性前立腺癌に対するアンドロゲン受容体シグナル阻害薬(エンザルタミドやアビラテロン,アパルタミド)などはわが国においても標準治療となってきているが,生殖細胞系列DDR関連遺伝子病的バリアントに対するアンドロゲン受容体シグナル阻害薬の有効性に関しては,定まった見解は得られていない(表1)。DDR関連の生殖細胞系列病的バリアントを認めた前立腺癌60例とDDR関連の生殖細胞系列病的バリアントを認めなかった330例を比較した後ろ向き検討では,アンドロゲン受容体シグナル阻害薬やドセタキセルでは予後に差がなかった8)。mCRPC319例を対象とした検討では,22例にBRCA1あるいはBRCA2等の相同組み換えに関連する遺伝子の生殖細胞系列病的バリアントを認め,これらの症例では内分泌療法開始後の去勢抵抗性になるまでの期間や,エンザルタミド・アビラテロンの奏効期間は有意に悪化した9)。一方でJohns Hopkins大学からの報告では,一次新規内分泌薬(エンザルタミド・アビラテロン)使用中の115例と二次新規内分泌薬を開始した57例における新規内分泌薬の効果とBRCA1あるいはBRCA2あるいはATM病的バリアントとの関連を評価したところ,BRCA1あるいはBRCA2あるいはATM生殖細胞系列病的バリアント保持の22症例においてrPFS・全生存期間の延長を認めた10)。抽出したサンプルの違いやバリアント解析法の違いあるが,いずれの試験もサンプルサイズが小さいという欠点がある。今後より大規模なコホートでの前向き検証が待たれる。
化学療法に関しては,mCRPCに対してドセタキセル・カルボプラチン併用療法を受けた144例を対象にBRCA2病的バリアント保持者におけるプラチナ製剤感受性が検討された。BRCA2病的バリアント保持者8例において有意に高いPSA奏効率(75%)を認め,BRCA2陽性症例においてカルボプラチンを用いた化学療法の有用性が期待された11)。Mateoらの報告8)では,DDR関連の生殖細胞系列病的バリアントを認めたmCRPC症例におけるドセタキセルの有用性について検討している。DDR関連遺伝子の病的バリアント非保持症例との間にrPFSの差はなく,DDR関連遺伝子における生殖細胞系列病的バリアントを有する症例においてもドセタキセルが有効であることが示唆されている。
BRCA2,BRCA1,prostate cancer,TOPARP—A,TOPARP—B,castration resistant prostate cancer,germline mutation,somatic mutation,parp inhibitor,prostatectomy,radiation therapy,active surveillance
