以下の条件を満たすクライエントに対して、BRCAの遺伝学的検査を提供することが推奨される。
- 発症、未発症に関わらず(本人以外に)すでに家系内でBRCA1または/かつBRCA2の病的バリアント保持が確認されている
- 乳癌を発症しており,以下のいずれかに当てはまる
- 45歳以下の乳癌発症
- 60 歳以下のトリプルネガティブ乳癌発症
- 2 個以上の原発性乳癌発症
- 第 3 度近親者内に乳癌または卵巣癌発症者が1名以上がいる
- 卵巣癌、卵管癌および腹膜癌を発症
- 男性乳癌を発症
- がん発症者でPARP阻害薬に対するコンパニオン診断の適格基準を満たす場合腫瘍組織プロファイリング検査で、BRCA1または/かつBRCA2の生殖細胞系列の病的バリアント保持が疑われる
解 説
本CQは、がんゲノム医療やPARP阻害剤のコンパニオン診断の普及や、日本人のHBOC関連の研究成果に伴い、国内のHBOC診療の現状をふまえ、2017年版を更新した。
乳癌や卵巣癌の易罹患性遺伝子として、最も頻度が高く、高浸透率であるのがBRCA1とBRCA2である。臨床的にHBOCを疑う場合や、コンパニオン診断としてBRCA遺伝学的検査の対象者となる場合には、選択肢の一つとしてBRCA遺伝学的検査に関する情報提供を行うことが大切である。これらの遺伝子に病的バリアントを認めるかどうかを明らかにする事は、①新たに生じる乳癌や卵巣癌に対して、ハイリスク群として検査や、予防(リスク低減手術、化学的予防)などによる適切な医学的管理の提供(→各論を参照)、②乳癌や卵巣癌のPARP阻害薬などの治療適応や効果予測、乳癌の術式選択の指標、③乳癌の術式選択の指標、に有用と考えられる。
BRCA遺伝学的検査の対象者の選定として、国内・海外の既存の「検査基準」と日本人の乳癌・卵巣癌のケースコントロールスタディの結果を参考にした。
(1)NCCNのガイドライン1)(表1)、(2)日本HBOCコンソーシアムのチェックリスト(表2)、(3)日本人の乳癌・卵巣癌のケースコントロールスタディ(表3)を以下に紹介する。
(1)NCCNガイドライン
表1 「NCCNガイドライン」(二次評価)専門家による詳細な評価に用いる項目
以下の項目に1つでも該当する場合、さらなる個別のリスク評価や遺伝カウンセリング、多くの場合において遺伝学的検査および管理を実施する根拠となる。

a: 第三度近親者内 b: 卵管癌、原発性腹膜癌も含む
(2)日本HBOCコンソーシアム
表2 日本HBOCコンソーシアムが採用しているチェックリスト

(3)日本人の乳癌・卵巣癌のケースコントロールスタディ
日本バイオバンクジャパンの血液のDNA検体を使用した報告で、日本人の7,093人の乳癌女性と家族歴のない癌未発症の60歳以上の女性11,260人、53人の男性乳癌と家族歴のない癌未発症の60歳以上の男性12,520人に対し、遺伝性乳癌関連遺伝子パネル(BRCA1, BRCA2, PALB2, TP53, PTEN, CHEK2, NF1, ATM, CDH1, NBN, STK11)を施行したケースコントロールスタディが報告された2)。この報告によると、7,093人の選択バイアスの無い乳癌女性の中で、BRCA1変異保持率は1.45%、BRCA2は2.71%であった。BRCA1/2を含む乳癌ハイリスク11遺伝子パネル検査の結果、病的バリアント保持群とバリアントなし群の臨床所見の比較(Supplementary Table4を一部改変)が表3である。病的遺伝子変異保持率がオッズ比(OR)>2となる因子は、卵巣癌の既往、両側乳癌、トリプルネガティブ乳癌、乳癌・卵巣癌・骨腫瘍・膀胱癌家族歴あり、であった。
表3 BRCA1/2を含む乳癌ハイリスク11遺伝子パネル検査の病的バリアント保持群とバリアントなし群の臨床所見の比較
| 変数 | 病的バリアントあり | 病的バリアントなし | P value | OR (95% CI) |
| 人数 | 404 | 6647 | ||
| 乳癌診断年齢 | 51.4±12.8 (393) | 56.1±11.9 (6240) | <0.01 | |
| 卵巣癌の既往 | 7/404 (1.7%) | 40/6607 (0.6%) | 0.017 | 2.9 (1.1-6.6) |
| 両側乳癌 | 20/282 (7.1%) | 104/4157 (2.4%) | <0.01 | 3.1 (1.8-5.1) |
| エストロゲンレセプター | 178/266 (66.9%) | 3360/4585 (73.3%) | 0.028 | 0.7 (0.6-1.0) |
| プロゲステロンレセプター | 125/262 (47.7%) | 2788/4513 (61.8%) | <0.01 | 0.6 (0.4-0.7) |
| トリプルネガティブ | 36/164 (22.0%) | 297/2935 (10.1%) | <0.01 | 2.5 (1.6-3.7) |
| 乳癌家族歴 | 94/404 (23.3%) | 740/6647 (11.1%) | <0.02 | 2.4 (1.9-3.1) |
| 卵巣癌家族歴 | 19/385 (4.7%) | 64/6647 (1.0%) | <0.03 | 5.1 (2.8-8.7) |
| 膵臓癌家族歴 | 24/404 (5.9%) | 220/6647 (3.3%) | 0.011 | 1.8 (1.1-2.9) |
| 胃癌家族歴 | 101/404 (25.0%) | 1353/6647 (20.4%) | 0.027 | 1.3 (1.0-1.7) |
| 肝臓癌家族歴 | 38/404 (9.4%) | 418/6647 (6.3%) | 0.017 | 1.5 (1.1-2.2) |
| 骨腫瘍家族歴 | 4/400 (1.0%) | 13/6647 (0.2%) | 0.014 | 5.1 (1.2-16.6) |
| 膀胱癌家族歴 | 15/404 (3.7%) | 99/6647 (1.5%) | <0.01 | 2.5 (1.4-4.5) |
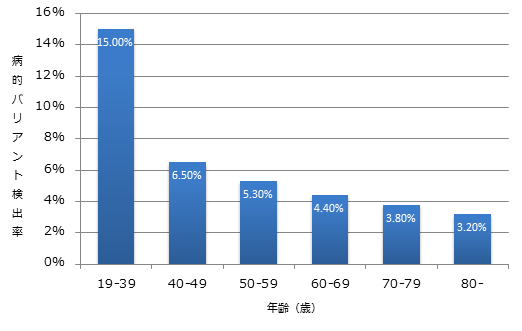
また、年齢別の病的バリアント検出率を図1に示す(Fig.2aを一部改変)
本研究では、年齢についてはORの数字がでていないが、39歳以下で検出率15%、40-49歳で6.5%、で、バンキングコントロール群では4.16%であり、45歳以下では10%前後の病的バリアント検出率である事が予想される。
図1: BRCA1/2を含む乳癌ハイリスク11遺伝子パネル検査の病的バリアント検出率
欧米ではBRCA生殖細胞系列病的バリアントを有する可能性が5-10%と想定されるクライエントに対して遺伝的リスク評価が勧められている3)。多くの民族・集団からの報告では上皮性卵巣癌の10%以上のクライエントでBRCA病的バリアントが検出されており,本邦の検討でも上皮性卵巣癌(卵管癌および腹膜癌を含む)のBRCA1病的バリアント検出率は8.3%、BRCA2は3.5%であると報告されている4)。
また、本邦では2018年7月に「がん化学療法歴のあるBRCA遺伝子変異陽性かつHER2陰性の手術不能又は再発乳癌」、2019年6月に「BRCA遺伝子変異要請の卵巣癌における初回化学療法後の維持療法」に対し、PARP阻害薬が拡大適応となり、BRCA遺伝学的検査はコンパニオン診断としても用いられるようになった。
さらにsomatic gene profilingの結果、腫瘍でBRCAに病的バリアントが認められた場合、70%以上が生殖細胞系列にBRCA病的バリアントを保持することが報告されている5)。
以上より、NCCNガイドラインと簡易チェックのうち、選択バイアスの無い日本人乳癌女性データからOR>2または、10%以上のBRCA病的バリアントを検出する因子と、すべての卵巣癌罹患者、コンパニオン診断対象者をBRCA遺伝学的検査を提供すべき対象とした。尚、前立腺癌、膵癌についての項目は、日本人のBRCA病的バリアント検出率について大規模な報告は十分でないため、今回は採用しなかった。
参考文献
-
NCCN Guideline Genetic/Familial High-Risk Assessment: Breast and Ovarian 2019 ver3.
-
Momozawa Y et al. Germline pathogenic variants of 11 breast cancer genes in 7,051 Japanese patients and 11,241 controls. Nature Communication 2018; 9: 4083
-
George A. UK BRCA mutation testing in patients with ovarian cancer. Brit J Cancer 113: S17-S21, 2015
-
Hirasawa A et al. Prevalence of pathogenic germline variants detected by multigene sequencing in unselected Japanese patients with ovarian cancer. Oncotarget. 2017;8(68):112258-112267.
-
Meric-Bernstam F et al. Incidental germline variants in 1000 advanced cancers on a prospective somatic genomic profiling protocol. Annals of Oncology 27: 795–800, 2016

