

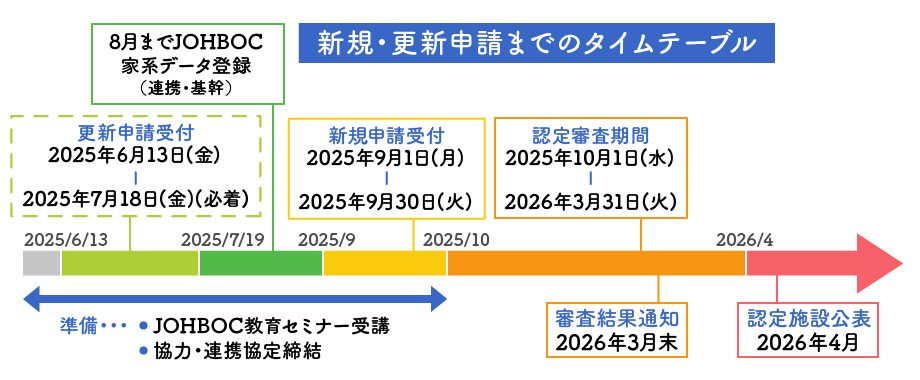
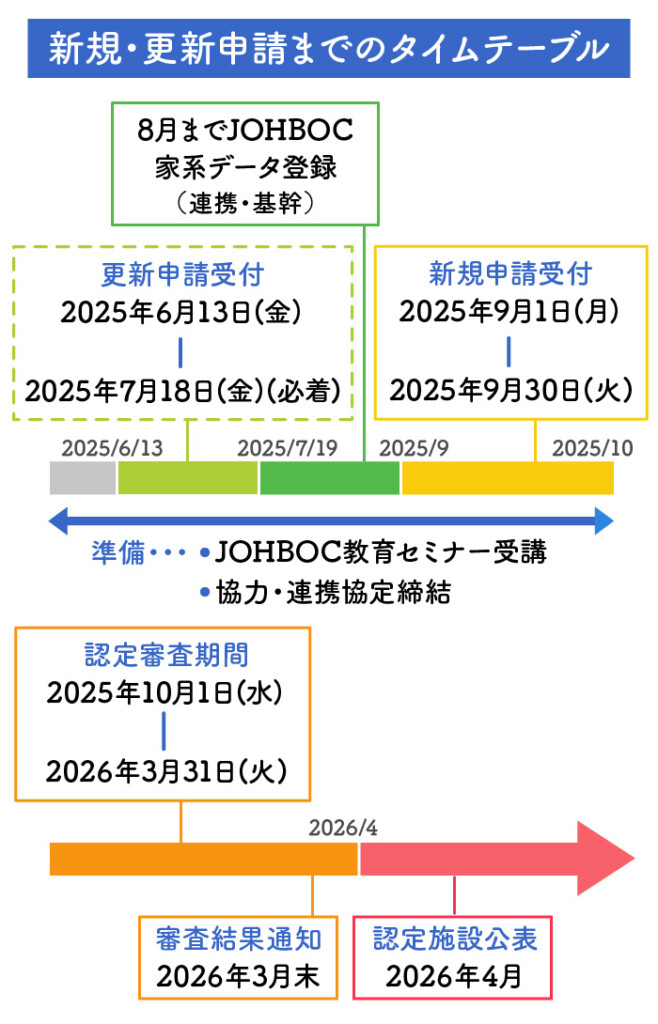
※連携以上を目指される場合、2025年4月末までに 登録事業への参加申し込みが必要となります。
なお、データ登録が完了していない場合でも申請は可能ですが、2026年2月末までにデータ入力を完了していただく必要がございます。
すべての書類をご提出ください。
*1『診療責任者』各施設におけるHBOC診療における実施医師(遺伝・乳腺・婦人科いずれの所属でも可)の代表を記載してください。
*2『連絡窓口担当者』診療責任者とは別の担当者を記載してください。
*3診療責任者・連絡窓口担当者のe-mailは必ず記載してください。
*4施設・機関長の公印を押印してください。

① 基幹施設要件は、別紙を参照して記載してください。
② 基幹施設の要件となっている『独立した臨床遺伝部門の設置』が確認できる資料としてご提出ください。
③ ④承認書は、未発症者(保険適用外)の手術も含めた承認であることがわかる通知書(保険適用前の審査も可)を添付ください。通知書の内容で未発症者への適用が承認されていることが不明瞭な場合は、該当する書類も添付ください。
承認書は、施設・機関長の公印のあるものが望ましいですが、公印省略の場合には、*4に施設・機関長の公印があることでその代用とします。
⑤ RRM、RRSO、両方の受領証の写しがあることをご確認ください。基幹施設は、保険診療(既発症者)・自費診療(未発症者)に対しRRMおよびRRSOが実施可能であることが必要です。
⑥ 乳腺、婦人科腫瘍、臨床遺伝専門医実施医師の専門医認定書の写しは、新たに認定する有効期間内に於いて有効である必要があります。
⑦ 認定遺伝カウンセラー®の認定書の写し(協力者に登録する場合)は、新たに認定する有効期間内に於いて有効である必要があります。
⑧ 実施医師・協力医師、認定遺伝カウンセラー®の履歴書(別添3、4、6)は、申請日現在の内容で作成ください。
⑨ 教育セミナー受講証の写しは、⑩の実施医師・協力者リストに記載されている全員分をご提出ください。ご提出の際には、セミナーの有効期限にご注意ください。アップデートセミナー等を受講し、有効期限の延長をされた場合には、初回受講セミナーの受講証も合わせてご提出ください。アップデートセミナー単独ではセミナー受講とみなされませんのでご注意ください。
⑩ 「実施医師・協力者リスト」のセミナー受講歴には、「初回セミナー」、あるいは「初回セミナー+更新セミナー」を選択してください。
⑪ 「遺伝学的検査外注契約書」は、表紙、押印のあるページのほか、契約されているBRCA1/2遺伝学的検査の項目がわかる部分もご提出ください。シングルサイト検査も含みます。
⑫ 受領書の写しとともに、保険診療によるBRCA1/2遺伝学的検査を委託している検査会社との検査契約書(⑪の書類)もご提出ください。
⑬ 全ての締結施設をご提出ください。連携協定書内の記載事項に記載漏れがないか確認してください。
①,②,⑥〜⑫の書類が必須です。
既発症者(保険診療)あるいは未発症者(自費診療)に対し、RRM、RRSOのいずれも実施可能であることが要件です。書類は③+④もしくは⑤いずれかをご提出ください。
*1『診療責任者』各施設におけるHBOC診療における実施医師(遺伝・乳腺・婦人科いずれの所属でも可)の代表を記載してください。
*2『連絡窓口担当者』診療責任者とは別の担当者を記載してください。
*3診療責任者・連絡窓口担当者のe-mailは必ず記載してください。
*4施設・機関長の公印を押印してください。
_補足2024-1024x507.jpg)
① 暫定基幹施設要件は、別紙を参照して記載してください。
② 暫定基幹施設の要件となっている『独立した臨床遺伝部門の設置』が確認できる資料としてご提出ください。
③ ④承認書は、未発症者(保険適用外)の手術も含めた承認であることがわかる通知書(保険適用前の審査も可)を添付ください。通知書の内容で未発症者への適用が承認されていることが不明瞭な場合は、該当する書類も添付ください。
承認書は、施設・機関長の公印のあるものが望ましいですが、公印省略の場合には、*4に施設・機関長の公印があることでその代用とします。
⑤ ③、④、⑤が全て揃いましたら、基幹施設への変更となります。
⑥ 乳腺、婦人科腫瘍、臨床遺伝専門医実施医師の専門医認定書の写しは、新たに認定する有効期間内に於いて有効である必要があります。
⑦ 認定遺伝カウンセラー®の認定書の写し(協力者に登録する場合)は、新たに認定する有効期間内に於いて有効である必要があります。
⑧ 実施医師・協力医師、認定遺伝カウンセラー®の履歴書(別添3、4、6)は、申請日現在の内容で作成ください。
⑨ 教育セミナー受講証の写しは、⑩の実施医師・協力者リストに記載されている全員分をご提出ください。ご提出の際には、セミナーの有効期限にご注意ください。アップデートセミナー等を受講し、有効期限の延長をされた場合には、初回受講セミナーの受講証も合わせてご提出ください。アップデートセミナー単独ではセミナー受講とみなされませんのでご注意ください。
⑩ 「実施医師・協力者リスト」のセミナー受講歴には、「初回セミナー」、あるいは「初回セミナー+更新セミナー」を選択してください。
⑪ 「遺伝学的検査外注契約書」は、表紙、押印のあるページのほか、契約されているBRCA1/2遺伝学的検査の項目がわかる部分もご提出ください。シングルサイト検査も含みます。
⑫ 受領書の写しとともに、保険診療によるBRCA1/2遺伝学的検査を委託している検査会社との検査契約書(⑪の書類)もご提出ください。
⑬ 全ての締結施設をご提出ください。連携協定書内の記載事項に記載漏れがないか確認してください。
①,⑤,⑦〜⑫の書類が必須です。
RRMあるいはRRSOのどちらかを、未発症(自費診療)と既発症(保険診療)共に実施していることが必要です。書類は②+④または③+④をご提出ください。
*1『診療責任者』各施設におけるHBOC診療における実施医師(遺伝・乳腺・婦人科いずれの所属でも可)の代表を記載してください。
*2『連絡窓口担当者』診療責任者とは別の担当者を記載してください。
*3診療責任者・連絡窓口担当者のe-mailは必ず記載してください。
*4施設・機関長の公印を押印してください。
_補足2024-1024x507.jpg)
① 連携施設要件は、別紙を参照して記載してください。
② ③承認書は、未発症者(保険適用外)の手術も含めた承認であることがわかる通知書(保険適用前の審査も可)を添付ください。通知書の内容で未発症者への適用が承認されていることが不明瞭な場合は、該当する書類も添付ください。
承認書は、施設・機関長の公印のあるものが望ましいですが、公印省略の場合には、*4に施設・機関長の公印があることでその代用とします。
④ RRM、RRSO、両方の受領証の写しがあることをご確認ください。
⑤ 乳腺、婦人科腫瘍、臨床遺伝専門医実施医師の専門医認定書の写しは、新たに認定する有効期間内に於いて有効である必要があります。
⑥ 認定遺伝カウンセラー®の認定書の写し(協力者に登録する場合)は、新たに認定する有効期間内に於いて有効である必要があります。
⑦ 実施医師・協力医師、認定遺伝カウンセラー®の履歴書(別添3、4、6)は、申請日現在の内容で作成ください。
⑧ 教育セミナー受講証の写しは、⑩の実施医師・協力者リストに記載されている全員分をご提出ください。ご提出の際には、セミナーの有効期限にご注意ください。アップデートセミナー等を受講し、有効期限の延長をされた場合には、初回受講セミナーの受講証も合わせてご提出ください。アップデートセミナー単独ではセミナー受講とみなされませんのでご注意ください。
⑨ 「実施医師・協力者リスト」のセミナー受講歴には、「初回セミナー」、あるいは「初回セミナー+更新セミナー」を選択してください。
⑩ 「遺伝学的検査外注契約書」は、表紙、押印のあるページのほか、契約されているBRCA1/2遺伝学的検査の項目がわかる部分もご提出ください。シングルサイト検査も含みます。
⑪ BRCA1/2遺伝子検査の施設基準に係る届出(様式23の3)に対する厚生局の受領書の写しをご提出ください。
⑫ 連携協定書内の記載事項に記載漏れがないか確認してください。
①,⑤,⑦〜⑫の書類が必須です。
未発症(自費診療)あるいは既発症(保険診療)に対し、RRM、RRSOが実施可能であることが必要です。書類は②または③、もしくは④のいずれかをご提出ください。
*1『診療責任者』各施設におけるHBOC診療における実施医師(遺伝・乳腺・婦人科いずれの所属でも可)の代表を記載してください。
*2『連絡窓口担当者』診療責任者とは別の担当者を記載してください。
*3診療責任者・連絡窓口担当者のe-mailは必ず記載してください。
*4施設・機関長の公印を押印してください。
_補足2024-1024x507.jpg)
① 暫定連携施設要件は、別紙を参照して記載してください。
② ③承認書は、未発症者(保険適用外)の手術も含めた承認であることがわかる通知書(保険適用前の審査も可)を添付ください。通知書の内容で未発症者への適用が承認されていることが不明瞭な場合は、該当する書類も添付ください。
承認書は、施設・機関長の公印のあるものが望ましいですが、公印省略の場合には、*4に施設・機関長の公印があることでその代用とします。
④ ②、③、④いずれかの書類をご提出ください。
⑤ 乳腺、婦人科腫瘍、臨床遺伝専門医実施医師の専門医認定書の写しは、新たに認定する有効期間内に於いて有効である必要があります。
⑥ 認定遺伝カウンセラー®の認定書の写し(協力者に登録する場合)は、新たに認定する有効期間内に於いて有効である必要があります。
⑦ 実施医師・協力医師の履歴書(別添3、6)は、申請日現在の内容で作成ください。
⑧ 教育セミナー受講証の写しは、⑩の実施医師・協力者リストに記載されている全員分をご提出ください。ご提出の際には、セミナーの有効期限にご注意ください。アップデートセミナー等を受講し、有効期限の延長をされた場合には、初回受講セミナーの受講証も合わせてご提出ください。アップデートセミナー単独ではセミナー受講とみなされませんのでご注意ください。
⑨ 「実施医師・協力者リスト」のセミナー受講歴には、「初回セミナー」、あるいは「初回セミナー+更新セミナー」を選択してください。
⑩ 「遺伝学的検査外注契約書」は、表紙、押印のあるページのほか、契約されているBRCA1/2遺伝学的検査の項目がわかる部分もご提出ください。シングルサイト検査も含みます。
⑪ BRCA1/2遺伝子検査の施設基準に係る届出(様式23の3)に対する厚生局の受領書の写しをご提出ください。
⑫ 連携協定書内の記載事項に記載漏れがないか確認してください。
①、⑤〜⑨の書類が必須です。
②、③、④、⑩は実施されている場合にご提出ください。
*1『診療責任者』各施設におけるHBOC診療における実施医師(遺伝・乳腺・婦人科いずれの所属でも可)の代表を記載してください。
*2『連絡窓口担当者』診療責任者とは別の担当者を記載してください。
*3診療責任者・連絡窓口担当者のe-mailは必ず記載してください。
*4施設・機関長の公印を押印してください。
_補足2024-1024x507.jpg)
① 協力施設要件は、別紙を参照して記載してください。
② ③承認書は、未発症者(保険適用外)の手術も含めた承認であることがわかる通知書(保険適用前の審査も可)を添付ください。通知書の内容で未発症者への適用が承認されていることが不明瞭な場合は、該当する書類も添付ください。
承認書は、施設・機関長の公印のあるものが望ましいですが、公印省略の場合には、*4に施設・機関長の公印があることでその代用とします。
④ ②、③、④いずれかの書類をご提出ください。
⑤ 乳腺、婦人科腫瘍専門医実施医師の専門医認定書の写しは、新たに認定する有効期間内に於いて有効である必要があります。
⑥ 実施医師・協力医師の履歴書(別添3、6)は、申請日現在の内容で作成ください。
⑦ 教育セミナー受講証の写しは、⑧の実施医師・協力者リストに記載されている全員分をご提出ください。ご提出の際には、セミナーの有効期限にご注意ください。アップデートセミナー等を受講し、有効期限の延長をされた場合には、初回受講セミナーの受講証も合わせてご提出ください。アップデートセミナー単独ではセミナー受講とみなされませんのでご注意ください。
⑧ 「実施医師・協力者リスト」のセミナー受講歴には、「初回セミナー」、あるいは「初回セミナー+更新セミナー」を選択してください。
⑨ 連携協定書内の記載事項に記載漏れがないか確認してください。
⑩ 保険診療によるBRCA1/2遺伝子検査を実施されている場合にご提出ください。
