Ⅱ-3 卵巣癌領域

RRSO 時にSTIC,p53 signature と診断された場合の追加治療の有効性に関するエビデンスはないのが現状である。
RRSO が実施された症例のうち,摘出検体に対する詳細な病理学的検討の結果,STIC やp53 signatureと診断される症例が存在する。また,少数ながらSTIC と同時に腹水細胞診陽性となるものも存在する。RRSO 時に肉眼的に明らかな卵巣癌,卵管癌,腹膜癌であった場合には,通常の卵巣癌,卵管癌,腹膜癌としてstaging laparotomy や化学療法を実施することになるが,RRSO 時にSTIC,p53 signature 陽性,腹水細胞診陽性と診断された症例に対するその後の治療・フォローアップ方法は確立していない。本FQ の臨床的な重要性を考慮し,当初FQ ではなくCQ として取り扱う方向でシステマティックレビューを行い,既存のエビデンスを集積してみたが,推奨するに十分なエビデンスが揃わなかった。最終的に,推奨決定会議での投票により,今回のガイドラインではFQ として取り扱うこととした。
RRSO 時に病理学的所見が認められた場合に考慮される追加治療として,staging laparotomy と化学療法があげられる。本FQ に対する文献検索の結果,PubMed 163 編,Cochrane 2 編,医中誌37 編が抽出され,これにハンドサーチ4 編を加えた計203 編がスクリーニング対象となった。2 名のシステマティックレビュー委員が独立して計2 回の文献スクリーニングを行い,抽出された症例集積研究17 編1)~17)がレビューの対象となった。
RRSO を実施された4,479 例(生殖細胞系列BRCA1/2 病的バリアント陰性156 例,遺伝学的検査未実施93 例,不明61 例を含む)のうち,STIC は102 例(2.3%,102/4479)に認められた。また漿液性卵管上皮内病変(serous tubal intraepithelial lesion:STIL)は7 例(2.6%,7/270),p53 signature は69例(16.5%,69/417)あった。腹水細胞診に関する記載は欠損が多く,STIC で腹水細胞診陽性であったのは83 例中5 例(6.0%,5/83)であった。
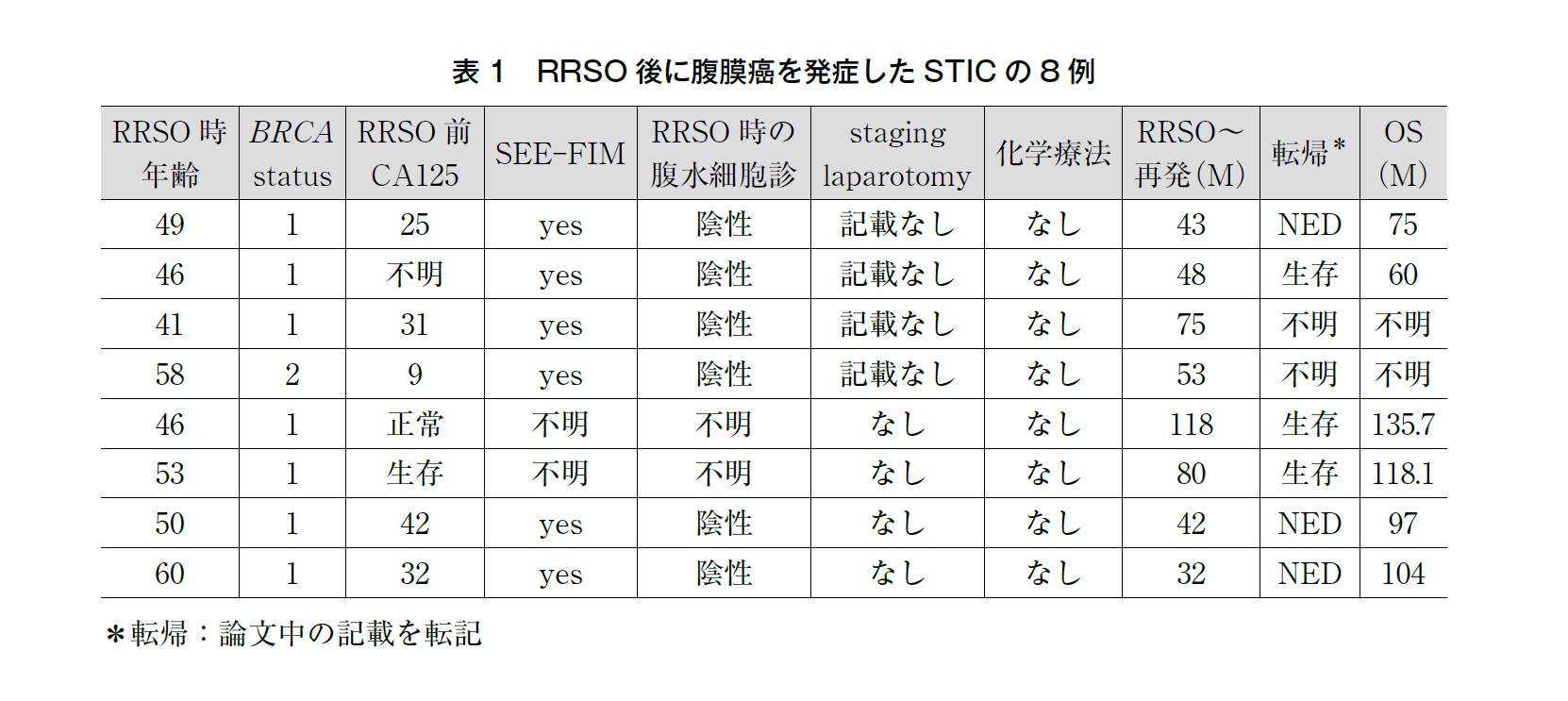
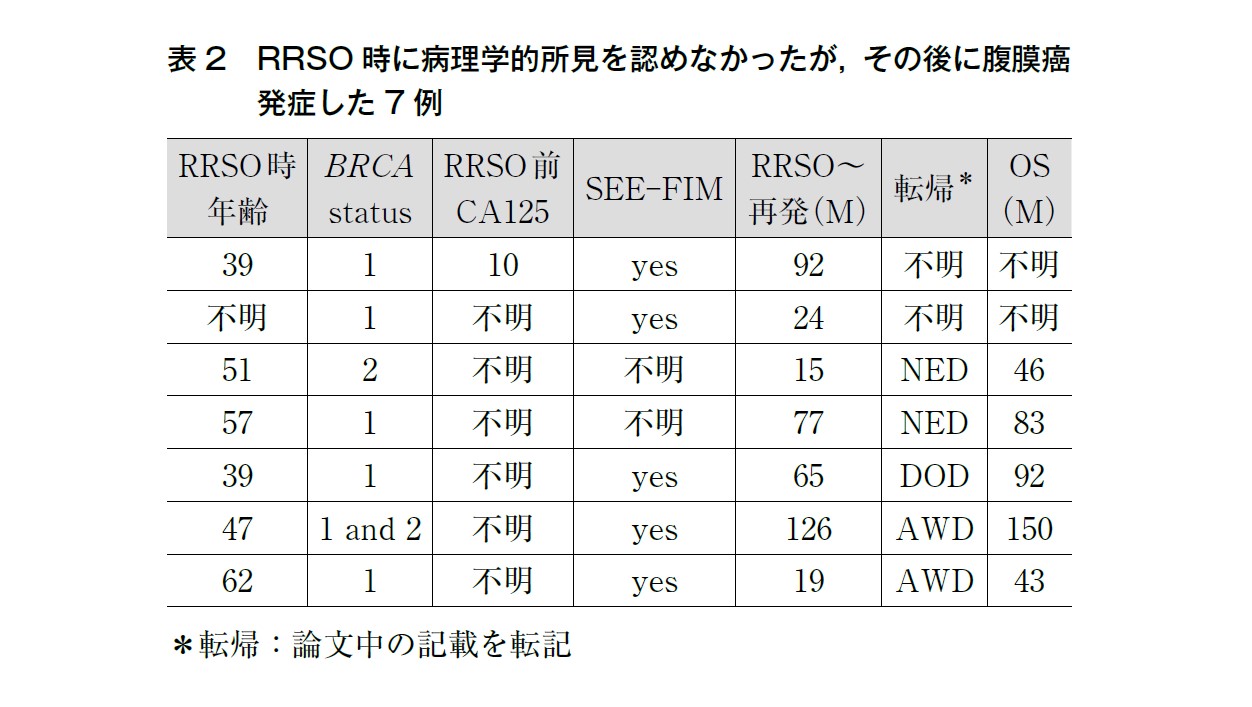
RRSO を実施された4,479 例のうち,RRSO 後に腹膜癌を発症したのが15 例(0.33%,15/4479),そのうち8 例はRRSO でSTIC を認めた症例(表1)で,残り7 例はRRSO で病理学的所見を認めなかった症例(表2)であった。
RRSO 後にSTIC と診断された102 例のうち,その後の腹膜癌発症の有無について記載があるのは100 例であった。100 例中8 例(8%,8/100)で,後に腹膜癌発症が確認された(図1)。この8 例がRRSOを施行された年齢の中央値は49.5 歳(41-60)で,BRCA1 が7 例,BRCA2 が1 例であった。8 例全例に化学療法は施行されていない。RRSO から腹膜癌発症までの期間の中央値は53 カ月(32-118),転帰について記載があった6 例全例が生存しており,OS の中央値は100.5 カ月(60-135.7)であった。
RRSO 時に病理学的所見を認めなかったが,その後に腹膜癌を発症したのは7 例(0.51%,7/1377)であり,RRSO が施行された年齢の中央値は49 歳(41-60),BRCA1 が5 例,BRCA2 が1 例,BRCA1とBRCA2 のtrans-heterozygotes が1 例であった。7 例中2 例はSEE-FIM プロトコルに従った検索がなされていなかった。RRSO から腹膜癌発症までの期間の中央値は65 カ月(15-126)で,OS の中央値は83 カ月(43-150)であり,1 例が92 カ月で死亡している。
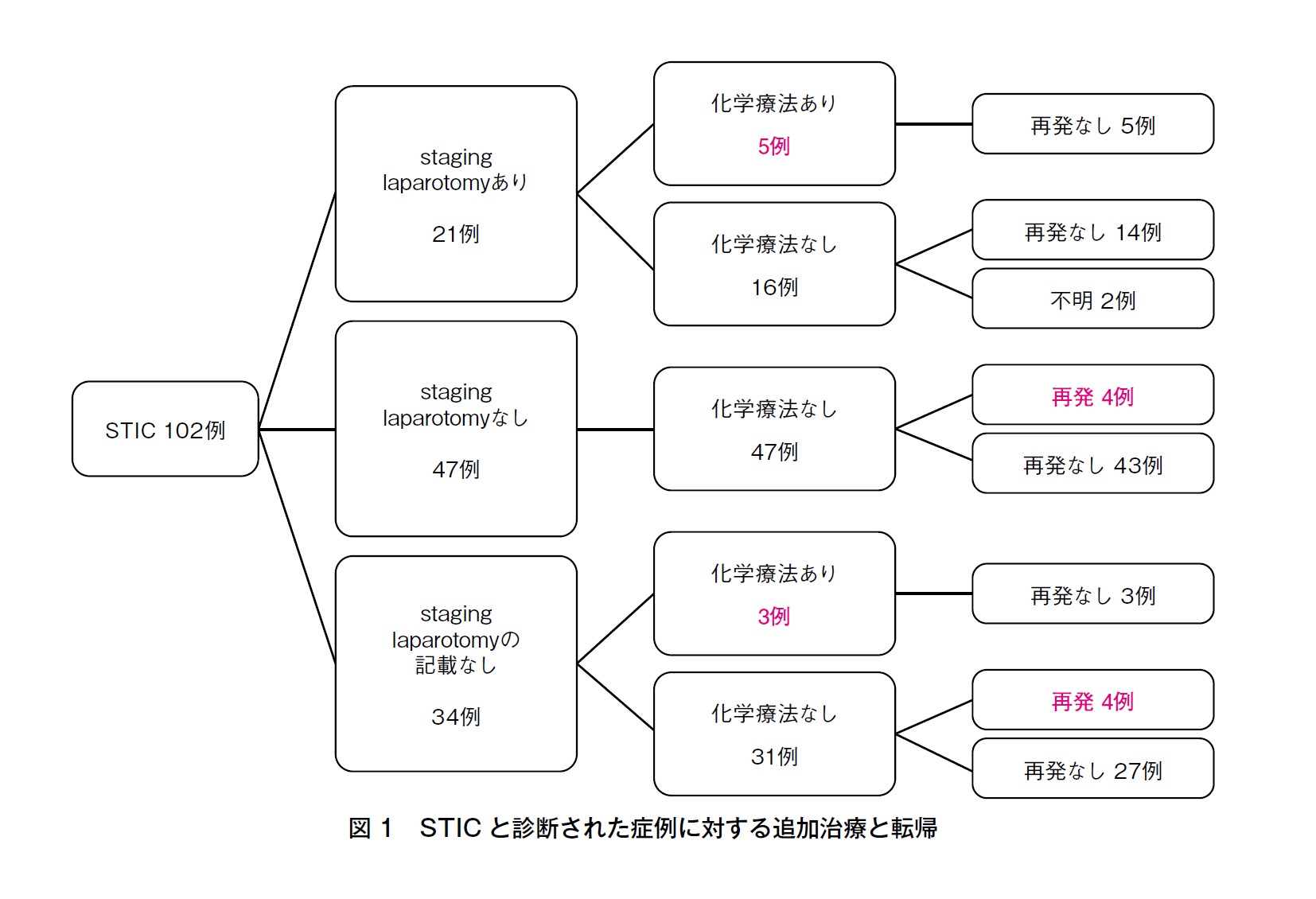
今回行われたシステマティックレビューでは,STIC と診断された102 例中,staging laparotomy 実施の有無について記載されていたのは68 例で,21 例(30.9%,21/68)に実施されていた。ただし,ここでのstaging laparotomy はリンパ節郭清を行っていない腹膜生検のみの症例も含まれており,STIC におけるリンパ節転移の割合,つまりupstage される症例の割合については言及できない。
STIC から腹膜癌を発症した8 例のうち4 例に,リンパ節郭清を含むstaging laparotomy が施行されていたが,残りの4 例ではstaging laparotomy が施行されたか否かの記載が無い。したがって,STIC と診断された際の腹膜病変やリンパ節転移の有無が不明である。
ESGO-ESMO-ESP ガイドライン18)では,「STIC と診断された後に追加のリンパ節郭清を行うことを推奨せず,peritoneal staging を推奨する」と記載されている。しかし,STIC 症例におけるリンパ節転移の頻度も不明であるうえに,peritoneal staging という用語もわが国においては明確に定義付けられたものではなく,生検の範囲についてもコンセンサスがあるとはいえない。記載内容の根拠となるエビデンスが乏しく,エキスパートの意見という範疇にとどまっていることに注意が必要である。
STIC 102 例のうち,化学療法を実施したのは8 例(7.8%,8/102)であった。この8 例では,RRSO施行時の腹水細胞診陽性が1 例,陰性が6 例,不明が1 例であった。また,これら8 例に対し,staging laparotomy が行われた症例が2 例,リンパ節郭清を伴わない再手術が1 例あった。化学療法を追加した8 例において,観察期間中央値58 カ月(7-105)において腹膜癌を発症した症例はなかった。これに対し,RRSO 後に腹膜癌を発症した15 例(0.33%,15/4479)はいずれも術後に化学療法を施行されていない。化学療法が腹膜癌の発症を減らす可能性は残るものの,その効果を評価するに十分なエビデンスが不足しており,今回のシステマティックレビューからは,化学療法の推奨に関するエビデンスは導けない。実臨床においては,化学療法の有害事象という害のアウトカムははっきりしているものの,治療効果である益のアウトカムがはっきりしていないため,患者の価値観によって方針にばらつきが出ることが考えられる。これに関してESGO-ESMO-ESP ガイドライン18)では「術後の化学療法を推奨しない」と記載されているが,この記載に関しても根拠となるエビデンスに乏しいエキスパートの意見であることに注意が必要である。
BRCA,RRSO,cytology,STIC,p53 signature,occult,chemotherapy,side effect,cost,patient preference
