遺伝性乳癌卵巣癌(hereditary breast and ovarian cancer:HBOC)は狭義にはBRCA1 あるいはBRCA2 の生殖細胞系列の病的バリアントに起因する乳癌および卵巣癌をはじめとするがんの易罹患性症候群であり,がんの発症,未発症を問わない。遺伝形式は常染色体顕性遺伝(優性遺伝)形式を示す。BRCA1 やBRCA2 以外の乳癌あるいは卵巣癌の易罹患性に関わる複数の遺伝子が同定されており,広義の遺伝性乳癌卵巣癌とすることもある。将来,これらの遺伝子病的バリアントに基づいて発症する乳癌や卵巣癌の臨床的な特徴が明らかになり,臨床的な対応が明確になればこの定義は変わる可能性もある。最近では遺伝子毎にがん発症リスクが異なることが解明され,HBOC と呼称するよりも,「BRCA1/2 関連腫瘍」等のように,遺伝子毎に定義されることもある。近年の遺伝性腫瘍に関する知見の蓄積や多遺伝子パネル検査(multi‒gene panel testing:MGPT)の発展を踏まえると,BRCA1/2 に限定せず広く遺伝性乳癌や卵巣癌の原因遺伝子をHBOC として取り扱う傾向がある1)。
ただし本ガイドラインではHBOC の代表的な遺伝子であるBRCA1/2 を中心に扱うことから,注記されない限りは「生殖細胞系列にBRCA1/2 病的バリアントを保持する場合にHBOC として取り扱う」ことを前提に,男女,発症者・未発症者の別なくHBOC と呼称することとする。
家系内に乳癌や卵巣癌を好発する家系が存在することから,がん発症と遺伝要因についての関連は19 世紀から示唆されていた。1990 年代に入り,連鎖解析の手法を用いてMary‒Claire King らにより家族性乳癌家系における原因遺伝子座が17q21 にマッピングされ2),1994 年にMiki らがBRCA1 を単離した3)。1994 年にはWooster らが連鎖解析を用いてBRCA1 に連鎖しない家族性乳癌の原因遺伝子座を13q12‒q13 にマッピングし4),1995 年にBRCA2 として単離した5)。
BRCA1/2 の単離から約30 年の間にHBOC 診療は飛躍的に発展し,リスク低減手法や分子標的薬の開発,血縁者診断に至る一連の方策が日常診療において実践されている。
わが国におけるBRCA1/2 病的バリアント保持者の検討については,2008 年Sugano らの135 人を対象とした多施設共同研究6),2015 年Nakamura らの260 人を対象とした他施設共同研究7)を経て,日本HBOC コンソーシアムが2015 年からHBOC 登録事業を開始しArai らが2018 年には830 家系のデータ解析結果を報告した8)。日本HBOC コンソーシアムは2019 年に日本遺伝性乳癌卵巣癌総合診療制度機構(JOHBOC)に発展し,現在も登録事業を継続中である(2024 年5 月時点,BRCA1/2 陽性登録者約4,500 人)。
BRCA1 とBRCA2 以外にも遺伝性乳癌卵巣癌に関わる疾患関連遺伝子が報告されている。それぞれの遺伝子毎に発症リスクの差などの特徴を理解し診療することが望まれる。さらには同一遺伝子上の病的バリアント部位毎に病態に関連した特徴が,genotype-phenotype として今後解明される可能性もある。
(1)相同組換え修復(HR)関連遺伝子
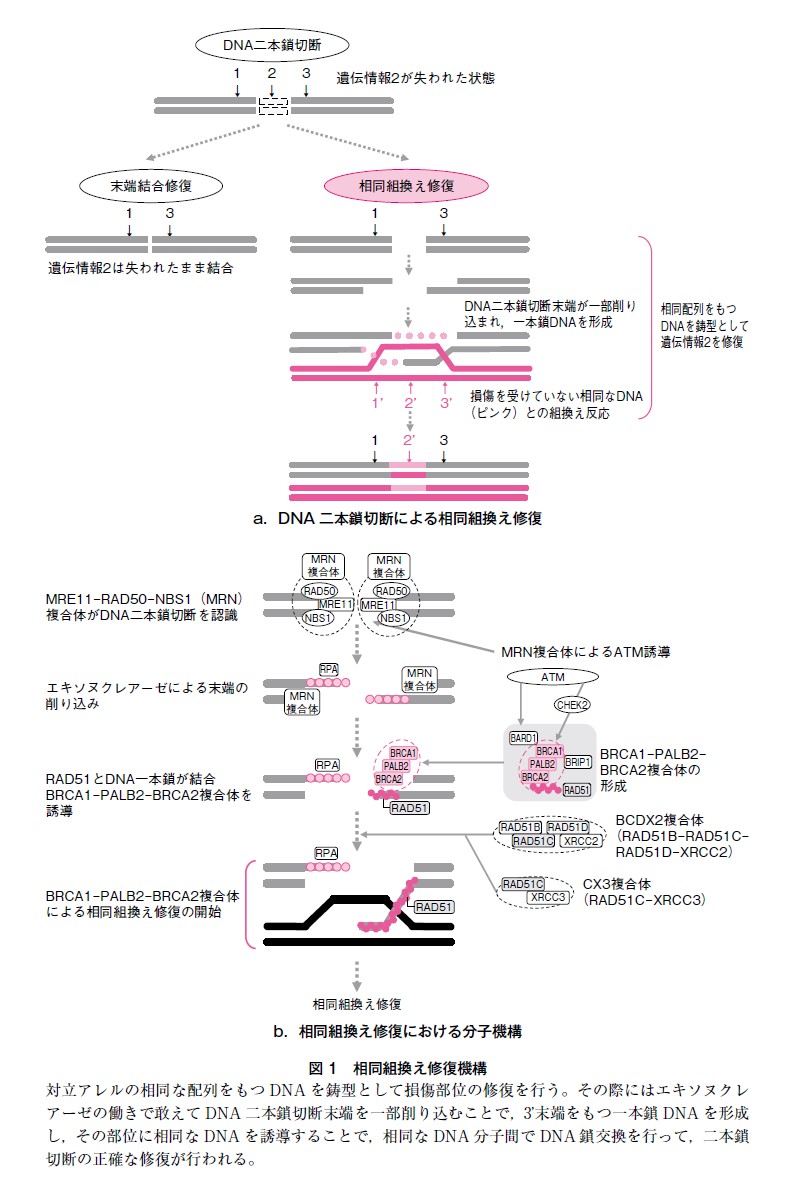
遺伝性乳癌や卵巣癌の発症リスクと関連する広義のHBOC 原因遺伝子として相同組換え修復(homologous recombination:HR)関連遺伝子があげられる。HR はDNA 損傷修復機構の1つでDNA二本鎖切断を修復する仕組みである(図1a)。DNA 損傷で二本鎖切断が起きた際,正確な遺伝情報を復元することを目的に,対立アレルの相同な配列をもつDNA を鋳型として損傷部位の修復を行う方法がHR と呼ばれる。その際にはエキソヌクレアーゼの働きで敢えてDNA 二本鎖切断末端を一部削り込むことで,3’末端をもつ一本鎖DNA を形成し,その部位に相同なDNA を誘導することで,DNA分子間でDNA 鎖交換を行って,二本鎖切断の正確な修復を行う。
この際,DNA ヌクレアーゼ複合体であるMRE11-RAD50-NBS1(MRN)は1 本鎖DNA への削り込みに関わる(図1b)。そしてMRN 複合体はDNA 修復部位にATM を誘導し,BRCA1-PALB2-BRCA2複合体を中心とするHR が開始され,HR 過程にはBARD1,BRIP1,CHEK2,RAD51C,RAD51D等の様々な分子が関わり,これらを総称してHR 関連遺伝子と呼ばれることがある。BRCA1/2 以外の遺伝性乳癌卵巣癌関連遺伝子がHBOC と同様の腫瘍発症リスクを有することが,HR に関連する分子作用機序から説明される。
(2)BRCA1
BRCA1 は染色体17q21 に位置する全長約110 kb の巨大な遺伝子であり,22 個のexon(エクソン)から構成されており,コーディング領域はexon2 の途中より始まり,exon11 が最も大きい。BRCA1のヒトmRNA の大きさは7.1 kb で,精巣で強く発現しているが,ほぼすべての臓器に発現がみられる。BRCA1 産物は1,863 個のアミノ酸からなる。N 末端側にはRING フィンガー構造が存在してユビキチンリガーゼ活性を有する。また中央部にはPALB2 との結合領域coiled-coil ドメインがあり,PALB2 を介してBRCA2 と結合する。C 末端部には細胞周期チェックポイントやDNA 修復に関与するタンパク質に広くみられるBRCT ドメインが2つ存在する。
BRCA1 の基本的な機能は主にDNA 恒常性の維持である。DNA 二本鎖切断の相同組換え修復に関わる他,チェックポイント機能により細胞周期を制御したり,多くの転写因子の補助因子として機能する。また,細胞死(アポトーシス)を制御して細胞増殖にも関与している3)。
BRCA1 病的バリアント保持者の頻度は各癌腫で異なる(遺伝BQ2 参照)。わが国における非がんコントロール集団においてBRCA1 病的バリアント保持者は0.04%の頻度とされている9)。
(3)BRCA2
BRCA2 は染色体13q12-13 に位置し,全長は約85 kb に及び,27 個のexon よりなる5)。BRCA1 と同様にコーディング領域はexon2 の途中から始まる。exon11 が極めて大きいが,BRCA1 との間に相同性はない。遺伝子産物は3,418 個のアミノ酸をコードする384 kDa の巨大な核内タンパクである。
BRCA2 の機能は主にDNA 二本鎖切断時の相同組換え修復である。また,BRCA2 はFanconi(ファンコニ)貧血の原因遺伝子でもあり,相補遺伝子群の中のFANCD1 として知られており,両アレルの欠失がFanconi貧血をきたす。この場合は常染色体潜性遺伝(劣性遺伝)の遺伝形式を示す。
BRCA2 病的バリアント保持者の頻度は各がん腫で異なる(遺伝BQ2 参照)。わが国における非がんコントロール集団においてBRCA2 病的バリアント保持者は0.17%の頻度とされ,BRCA1 よりも多く推定される9)。
(4)その他
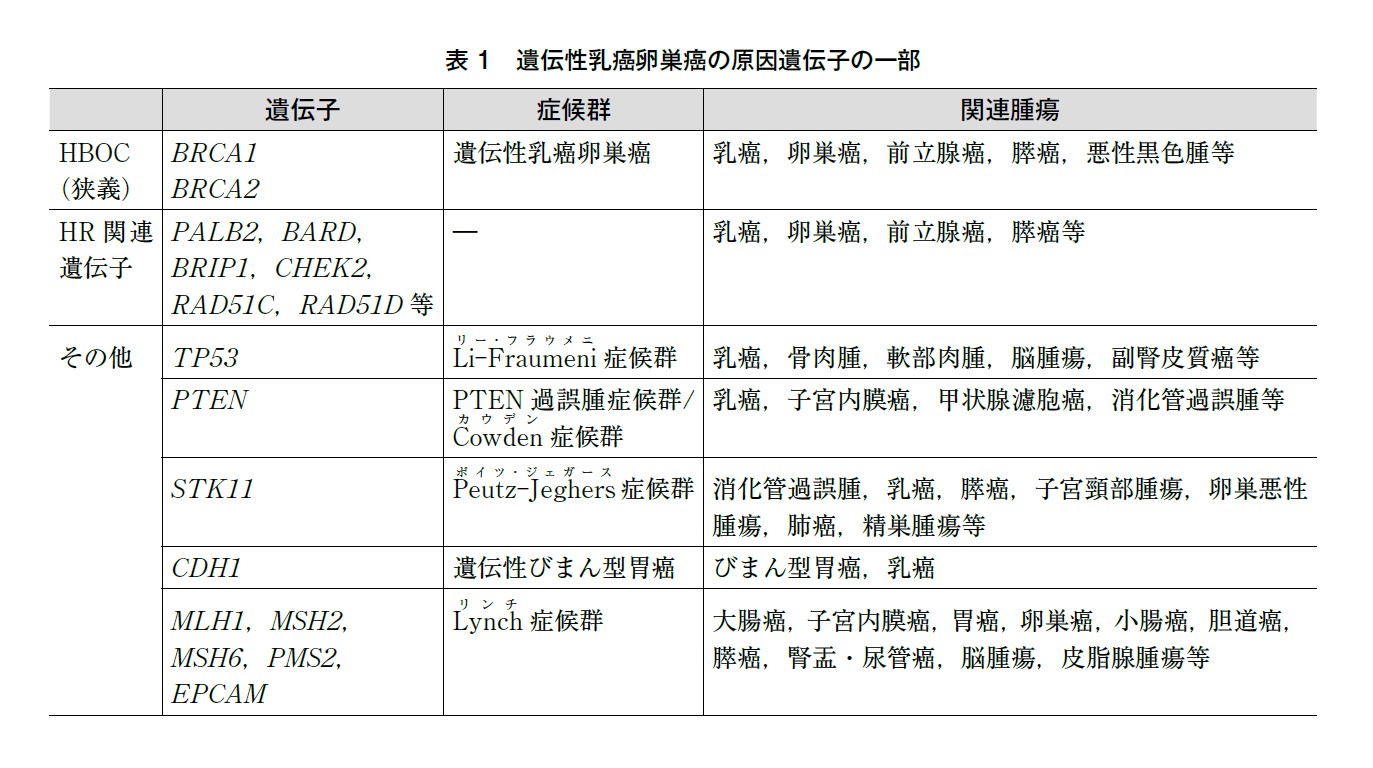
遺伝性乳癌卵巣癌の原因遺伝子として,BRCA1/2 やHR 関連遺伝子以外にも様々な遺伝性腫瘍が知られている(表1)。遺伝性乳癌に関しては,TP53,PTEN,STK11,CDH1 等,遺伝性卵巣癌に関してはMLH1,MSH2,MSH6,PMS2,EPCAM 等があげられ1),近年臨床に導入されつつあるMGPT には対象遺伝子として含まれることが多い。
従来のBRCA1/2 を対象とした遺伝学的検査は,約2~7 mL の末梢血採血を行い白血球よりDNAを抽出し,2 つの遺伝子の配列変化ならびに構造変化の有無を解析し,病的バリアントが検出された場合にHBOC と確定診断される。遺伝学的検査の際はexon およびexon-intron 境界領域を含むDNA配列について調べるPCR ダイレクトシーケンス(PCR-direct sequence)法およびMLPA(multiplex ligation-dependent probe amplification)法を用いて行うのが一般的であるが,検査会社毎に解析方法の差異があり詳細は各検査会社の解析手法を参照する必要がある。近年のMGPT をはじめとする遺伝学的検査では,次世代シーケンサーを用いた解析が主流である。PCR ダイレクトシーケンス法はexon およびexon-intron 境界領域の塩基置換,数塩基程度の欠失や重複等を解析する。MLPA 法はexon 単位の遺伝子再構成の有無を診断する。日本人ではMLPA により診断可能な病的バリアントは全病的バリアントの5%以下で頻度は低いが,exon 単位の大欠失等を否定するために実施しておく必要がある10)。
遺伝学的検査結果を血縁者診断に用いる場合,病的バリアントと報告された発端者の解析結果に基づいて,発端者の病的バリアントと同じバリアントを,血縁者が保持するかどうかを判断するための検査はシングルサイト検査と呼ばれることが多い。シングルサイト検査では発端者の遺伝学的診断に至った方法と同一の手法で解析することが,発端者検体をpositive control として検査精度管理上真の陽性,真の陰性を判定するうえで望ましい。また,発端者の遺伝学的診断が行われた検査解析手法を理解したうえで,単一バリアントを解析するのか,広い領域を対象としたMLPA 法での解析が必要なのか,あるいは遺伝子全体のフルシーケンスを含む解析を選択するのか,確認のうえで血縁者診断を行うことが肝要である。
わが国におけるBRCA 遺伝学的検査は,BRACAnalysis 診断システム検査による「BRCA1/2 遺伝子検査」として保険収載され,ポリ(ADP-リボース)ポリメラーゼ〔poly(ADP-ribose)polymerase:PARP〕阻害薬(オラパリブ)のコンパニオン診断として保険適用となり,保険点数20,200 点が算定されるようになった。従来,生殖細胞系列の遺伝子配列を精査する検査手法は遺伝学的検査と呼称されるが,この検査は保険収載時「BRCA1/2 遺伝子検査」として登録されており,本ガイドラインでも記載は保険収載名に倣うこととする。
わが国における「BRCA1/2 遺伝子検査」をPARP 阻害薬のコンパニオン診断とすることは,はじめに2018 年7 月に「がん化学療法歴のあるBRCA 遺伝子変異陽性かつHER2 陰性の手術不能または再発乳癌」,続いて2019 年6 月に「BRCA 遺伝子変異陽性の卵巣癌における初回化学療法後の維持療法」,さらに2020 年12 月に「BRCA 遺伝子変異陽性の遠隔転移を有する去勢抵抗性前立腺癌」および「BRCA遺伝子変異陽性の治癒切除不能膵癌におけるプラチナ系抗がん剤を含む化学療法後の維持療法」として適応拡大し,2022 年8 月には,「BRCA 遺伝子変異陽性かつHER2 陰性で再発高リスクの乳癌における術後薬物療法」を効能・効果として追加承認された。2024 年1 月には「がん化学療法歴のあるBRCA 遺伝子変異陽性かつHER2 陰性の手術不能又は再発乳癌」の治療薬としてタラゾパリブが新たに保険適用となった。卵巣癌領域ではプラチナ製剤感受性再発卵巣癌の維持療法として,BRCA1/2病的バリアントの有無にかかわらずPARP 阻害薬の投与対象が拡大されている。本疾患をとりまく状況は日進月歩であり,診療に際しては最新の情報に留意した情報収集が望まれる。
一方,HBOC 診断後の医学的介入を目的とした「BRCA1/2 遺伝子検査」も2020 年4 月からは条件を満たす乳癌患者およびすべての卵巣癌患者に一部保険収載された。BRCA1/2 病的バリアント保持が確認された乳癌,卵巣癌患者に対するリスク低減卵管卵巣摘出術(risk reducing salpingo-oophorectomy:RRSO)とリスク低減乳房切除術(risk reducing mastectomy:RRM)が保険適用となり,同じタイミングでリスク低減手術を受ける選択をしないBRCA1/2 病的バリアント保持者に対し,早期発見を目的としたサーベイランスも一部保険適用となった。ただし,保険診療での対象者は限定的であり,対象がん種が限られることや未発症者を対象としていない点は,HBOC 診断に基づいた適切な医学的管理の実施についての課題である(詳細は各論参照)。
BRCA1/2 に病的バリアントを認めなかった症例について,既往歴・家族歴等による詳細な遺伝学的アセスメントでその他の遺伝性腫瘍の可能性を十分に吟味することなく,看過してしまう場面が危惧される。既往歴・家族歴等の患者背景に応じて,表1 に示すようなBRCA1/2 以外の遺伝性腫瘍関連遺伝子について検索が推奨される症例もある。そのような場合に現在は単一の遺伝性腫瘍を念頭に置いた遺伝学的検査を行うよりも,複数の遺伝性腫瘍関連遺伝子を包含したMGPT を行うほうが一般的である(遺伝BQ2 参照)。
近年,腫瘍組織検体のがん遺伝子解析に基づく治療戦略構築が実臨床に導入されている。わが国においても2019 年6 月に,がん個別化医療のための遺伝子解析として「がん遺伝子パネル検査」が保険収載された。また,2021年1月よりmyChoice診断システムが,相同組換え修復欠損(homologous recombination deficiency:HRD)および腫瘍組織から抽出したゲノムDNA 中のBRCA1 またはBRCA2 病的バリアントを検出するPARP 阻害薬のコンパニオン診断として用いられている。
がん遺伝子パネル検査本来の目的以外で発見される生殖細胞系列の所見は,germline findings と呼ばれる。がん遺伝子パネル検査で,遺伝性腫瘍の発症に関連した生殖細胞系列の遺伝子の変化等が検出される可能性は5~15%程度あると報告されている11)。卵巣癌領域で用いられるmyChoice 診断システムは組織検体のみを用いた解析であるため,germline 由来のBRCA1/2 病的バリアントの有無は確定ではない。
このようにgermline findings として生殖細胞系列に遺伝性腫瘍関連遺伝子の変化が検出された場合,コンパニオン検査を受けた患者本人の治療選択に活用できる場面もある。あるいは患者本人の治療に直接役立てられずとも,遺伝学的診断によりがん罹患リスクが高い情報が血縁者と共有することができれば,血縁者の今後の健康管理に活かすことができる(遺伝BQ1 参照)。
HBOC 診断の際に遺伝学的配慮が必要な背景として,遺伝学的検査の特性を理解する必要がある。遺伝学的検査の特性として,結果が生涯変化せず,血縁者間で一部共有され,血縁関係にある親族について影響があること等を鑑み,遺伝学的検査前に検査に関わる詳細や結果がもたらし得る影響について十分に情報提供し理解を助けるプロセスとして,遺伝カウンセリングが重要視されてきた。遺伝カウンセリングとは,「医学における遺伝学的検査・診断に関するガイドライン」12)において「疾患の遺伝学的関与について,その医学的影響,心理学的影響および家族への影響を人々が理解し,それに適応していくことを助けるプロセスである」と定義されている。また,「遺伝カウンセリングに関する基礎知識・技能については,すべての医師が習得しておくことが望ましい。また,遺伝学的検査・診断を担当する医師および医療機関は,必要に応じて,専門家による遺伝カウンセリングを提供するか,または紹介する体制を整えておく必要がある」と記載がある。
保険診療としての「BRCA1/2 遺伝子検査」は主治医が担当している施設が多いと考えられるが,遺伝学的検査結果の解釈に難渋する症例やその他の遺伝性腫瘍が否定できない症例,また未発症家系員への遺伝学的検査前後の遺伝カウンセリング等は専門的な知識を有する医療者との連携が不可欠である。HBOC 診療は一診療科だけで成り立つものではなく,各科連携のもとに患者にとって最善の医療を提供できる体制を個々に整備することが肝要である。
2022 年3 月に11 年ぶりに改訂された日本医学会の「医療における遺伝学的検査・診断に関するガイドライン」12)では,保険診療での遺伝学的検査の拡充等を踏まえ「遺伝情報の特性を十分に理解し,遺伝学的検査・診断を実施し,診療記録として共有すること」,「すべての医療従事者が遺伝医学に関する十分な理解と知識および経験を持ち,日進月歩の遺伝学的検査・診断に関する情報を得るとともに,必要に応じて,遺伝医療の専門家と連携を持つこと」の必要性が明示された。遺伝情報の取り扱いに際しては配慮が必要であることは自明であるが,医療者間で共有することの臨床上の意義を十分に理解し,各医療者が適切に取り扱うことが求められている。
現在保険診療での「BRCA1/2 遺伝子検査」が条件を満たす患者に実施可能となり,多くの施設では主治医から検査前の説明と結果開示が行われている。その際,主治医が遺伝性腫瘍や遺伝学的検査に関する最新のガイドライン等で知識を得て,「BRCA1/2 遺伝子検査」の提出から結果開示とその先の治療に至るまで,適切な医療提供をするべく責任をもって診療にあたることが重要である13)。主治医に求められる役割については,日本乳癌学会14),日本婦人科腫瘍学会15),日本泌尿器科学会16),日本膵臓学会17)がそれぞれ提言を出しているので参考にされたい。施設内に遺伝医療に精通したスタッフがおらず,患者や家族がより詳しい遺伝についての相談を希望した場合は,遺伝医学の専門家と連携をとりながら,その後の心理社会的支援を含めて継続的なフォローを提供できる体制が望ましい。
BRCA1 およびBRCA2 病的バリアント保持者の乳癌累積罹患リスクは,それぞれ80 歳で72%,69%とされる18)。欧米の報告ではBRCA1 病的バリアント保持者の乳癌は,トリプルネガティブ乳癌の割合が68%と高く核異型度が高く,BRCA2病的バリアント保持者の組織型は通常の乳癌と同様で,ホルモン受容体陽性HER2 陰性のLuminal タイプが84%を占めた19)。わが国におけるBRCA1 病的バリアント保持者の乳癌の83%がトリプルネガティブ乳癌であり20),75%が核異型度3 以上21)と,欧米と同様の傾向である。また,男性のBRCA2 病的バリアント保持者の男性乳癌の累積罹患リスクは7~8%22)である。
BRCA1 およびBRCA2 病的バリアント保持者の卵巣癌累積罹患リスクは,それぞれ80 歳で44%,17%である18)。またわが国からの報告で,BRCA1/2 病的バリアント保持者の卵巣癌において組織型では85%が漿液性腺癌であり,また,Ⅲ期,Ⅳ期の進行症例が8 割を占めた23)。BRCA1/2 病的バリアント保持者のリスク低減手術で切除された卵管に,漿液性卵管上皮内癌(serous tubal intraepithelial carcinoma:STIC)が認められ,一部の卵巣癌は卵管采由来であることが示唆されている24)(卵巣癌 BQ1 参照)。
男性では前立腺癌の罹患リスクが高く,特にBRCA2 病的バリアント保持者では一般の2~6 倍の罹患リスクがあるとされる。わが国からの報告では,BRCA2 病的バリアント保持者の累積前立腺癌発症リスクは80 歳で27%であった25)。またBRCA1/2 病的バリアント保持者に発症する前立腺癌は悪性度が高い傾向を認め,遠隔転移やリンパ節転移の頻度が高く,予後が不良である26)。監視療法(active surveillance)からの逸脱の頻度は,BRCA1/2 やATM 病的バリアント保持者で有意に高かったという報告27)から,積極的な治療介入が検討される(前立腺癌BQ1,FQ1 参照)。
欧米のデータでは,BRCA1 およびBRCA2 病的バリアント保持者の膵癌累積罹患リスクは,3~4%,2~5%である28)。わが国からのデータでは,85 歳までの膵癌罹患リスクはBRCA1 で16.0%,BRCA2で 13.7%である25)(膵癌BQ1)。
わが国からの大規模な症例対照研究の結果,BRCA1/2 病的バリアント保持者では上述のがん種以外にも,BRCA1 と胆道癌(85 歳までの推定累積罹患リスク11.2%),BRCA2 と食道癌(85 歳までの推定累積罹患リスク5.2%),BRCA1 と胃癌(85 歳までの推定累積罹患リスク21.3%),BRCA2 と胃癌(85歳までの推定累積罹患リスク19.3%)の発症リスクが関連することが報告された25)。またBRCA1/2 を含むHR 関連遺伝子バリアント保持者における胃癌発症リスクに関して,ヘリコバクター・ピロリ(Helicobacter pylori:HP)感染がリスクを高めたことが報告され29),HP 除菌は胃癌発症リスクを低減させる可能性がある。がん遺伝子パネル検査やMGPT の結果,これまでのBRCA1/2 関連腫瘍と想定されていなかったがん罹患者で,BRCA1/2 病的バリアント保持が判明することもある。一概に関連腫瘍に限って検討するスクリーニング方法には限界があると考えられ,既往歴・家族歴を考慮した個別のマネージメント検討が必要なケースもある1)。
一般にBRCA1/2 病的バリアント保持者に対してはがん予防法を伝える必要があり,リスク低減を目的とした乳房全切除術および卵管卵巣摘出術とサーベイランスが選択肢となる。同時にBRCA1/2病的バリアント保持者であることが明らかになった患者家族に対して,それぞれの家系員の発がんリスクについて正しく評価することが重要である。
一次予防とは,がん発生リスク低減のための予防的措置が該当する。すなわち,ある特定のがんに対する発症リスク低減効果を期待して行う薬物療法と,がん発症臓器を切除し発がんリスクを回避することを目的とするリスク低減手術を指す(詳細は各論参照)。
二次予防とは,早期発見・早期治療に努めることで予後改善を期待する方策を指し,サーベイランスが該当する。すなわち,サーベイランスは遺伝学的に発がんリスクの高いと推定される方に対して,きめ細かく計画的に,がんの早期発見を目的として継続的に提供される検査を指す(詳細は各論参照)。
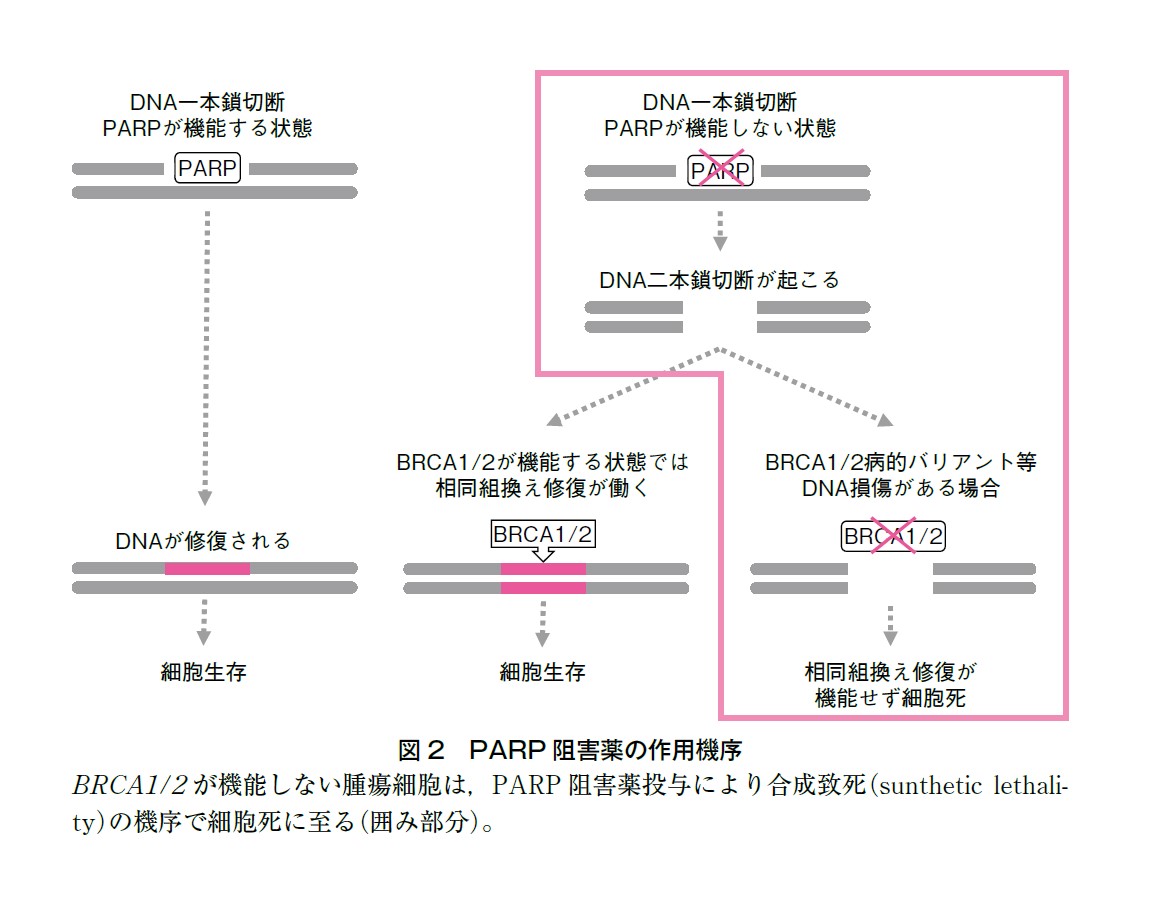
PARP 阻害薬の作用機序は,DNA 損傷修復の1 つでDNA 一本鎖切断を修復する仕組みである塩基除去修復に関わるPARP の酵素阻害である。DNA 損傷が起こった際,通常は一本鎖切断による塩基除去修復機構が働くが,PARP が機能できないと代替としてDNA 二本鎖切断による相同組換え修復機構が働くことになる。BRCA1/2 病的バリアントはDNA 二本鎖切断による相同組換え修復でDNA損傷修復を行う。BRCA1/2 関連腫瘍の場合,DNA 損傷修復機構は一本鎖切断による塩基除去修復に頼ることになるが,この機序をPARP 阻害薬が阻むことでDNA 損傷修復が不可能となり,細胞死に導かれる。BRCA1/2 病的バリアント保持者であっても,片アレルが機能していればBRCA1/2 が機能するためPARP 阻害薬を投与しても細胞死には至らず,BRCA1/2 がLOH や2 hit により機能を喪失したがん細胞特異的に細胞死に至らしめることが期待され,このように2つのカスケードを障害することは合成致死(synthetic lethality)と呼ばれる細胞致死のメカニズムである30)(適応の詳細は各論参照)。
術前にBRCA1/2 病的バリアント保持が判明している場合,手術方針に反映させることも考えられる。乳癌手術に際して,術後の新規がん発症リスクを考慮し,術式決定を行う場面も増えている。施設によっては,早期乳癌手術と同時にリスク低減手術を実施する方法をとることもあり,それぞれの患者の病勢と臨床背景を考慮し,医学的適応を判断する場面が医療者に求められる(詳細は各論参照)。
BRCA1,BRCA2,HR 関連遺伝子,PARP 阻害薬
