Ⅱ-1 遺伝子診断・遺伝カウンセリング領域
HBOC を含む遺伝性腫瘍が疑われるクライエントでの遺伝学的検査の国際標準は多遺伝子パネル検査(MGPT)である。MGPT では,BRCA1,BRCA2をはじめとする相同組換え修復(HRR)遺伝子,ミスマッチ修復(MMR)遺伝子を含む多数の高~中浸透率遺伝子における生殖細胞系列のバリアントを一度に検出することが可能である。MGPT で考慮すべき点は,病的意義不明のバリアント(VUS)の検出率が高くなること,予想外の病的バリアントが検出される可能性があること,臨床的有用性が不明な病的バリアントへの対応が必要となる可能性があること,である。今後わが国においても,MGPT が,結果解釈の支援体制や症例登録体制を整備したうえで,保険収載された遺伝性腫瘍診断の標準的検査法になることが望まれる。
近年,多遺伝子パネル検査(multi-gene panel testing:MGPT)を用いた解析から,BRCA1,BRCA2 以外の遺伝子と乳癌,卵巣癌,膵癌,前立腺癌の発症リスクに関するデータが集積されている。世界的に引用されるNCCN ガイドラインでは,BRCA1 とBRCA2 をはじめとする相同組換え修復(homologous recombination repair:HRR)遺伝子やDNA 損傷修復(DNA damage repair:DDR)遺伝子,ミスマッチ修復(mismacth repair:MMR)遺伝子について,HBOC を含む遺伝性腫瘍と診断される症例に対して推奨される医学的管理が,関連臓器毎に随時更新されている。MGPT にはBRCA1/2 以外のHRR 遺伝子,卵巣癌と関連のあるLynch(リンチ)症候群の原因遺伝子やその他の高浸透率遺伝子等が包含されていることが多い。がんの現病歴,既往歴,家族歴からHBOC を含む遺伝性腫瘍を疑う来談者での遺伝カウンセリングでは,BRCA1,BRCA2 以外の遺伝子に関する情報提供が必須となっている。
現病歴,既往歴,家族歴からHBOC を疑う症例での遺伝学的検査ではわが国において,保険収載されたBRCA1/2 単独の遺伝学的検査(BRACAnalysis 診断システム)と,複数の生殖細胞系列の遺伝子を解析するMGPT がある。MGPT は2024 年5 月現在保険収載されていない。BRCA 遺伝学的検査の使用目的・効果は,PARP 阻害薬のオラパリブの乳癌患者,卵巣癌患者,膵癌患者または前立腺癌患者への適応を判定するための補助(コンパニオン診断)と,HBOC のリスクが高い患者を特定して医学的管理決定に必要な罹患リスク判定(HBOC の遺伝学的検査)で承認されている1)。卵巣癌,卵管癌,腹膜癌患者と一部の乳癌患者では,BRACAnalysis を用いたHBOC の遺伝学的検査の実施が可能である。BRCA 遺伝学的検査の測定原理はPCR 法とサンガーシーケンス法によるシーケンスバリアントの検出と,マルチプレックスPCR 法による大規模再構成の検出である。
一方,次世代シーケンシング(next generation sequencing:NGS)技術を用いたMGPT の医療実装が2010年頃より解析コストの低価格化によって進み,一度に多くの生殖細胞系列の遺伝子解析が臨床検査として実施可能となった。2013 年以降は米国連邦最高裁判所の判決によってMyriad Genetics 社の特許独占が解除されたことを契機に,Myriad Genetics 社以外の検査開発会社や遺伝子診断サービス会社がBRCA1 とBRCA2 に関する遺伝子解析診断に参入可能となり,MGPT の開発が進んだ。米国での後ろ向きコホート研究によると,2015 年下半期には,乳癌患者での遺伝学的検査でのMGPTの実施件数は,調査対象の66.5%を占め,BRCA1/2 単独の遺伝学的検査数(同・33.5%)の約2倍に達したことが報告されている2)。
MGPT では,BRCA1,BRCA2 およびBRCA1/2 以外のHRR 遺伝子(ATM,CHEK2,BARD1,BRIP1,PALB2,RAD51C,RAD51D 等),MMR 遺伝子(MLH1,MSH2,MSH6,PMS2,EPCAM),他の遺伝性腫瘍の原因遺伝子(TP53,PTEN,STK11,CDH1)等,高~中浸透率遺伝子を主体とした30~70 個程度の遺伝子を包含するMGPT が,国内の複数の登録衛生検査所から提供されている。
MGPT の遺伝性腫瘍診断における臨床的有用性は2010 年代にすでに米国から報告されている。選択バイアスのない卵巣癌,卵管癌,腹膜癌患者360 症例を対象に実施したMGPT による検討やBRCA遺伝学的検査未実施の乳癌患者1,781 症例を対象にしたMGPT によるコホート研究では,21~25 個の遺伝子を搭載したMGPT によって,BRCA1/2 単独の遺伝学的検査に比べて病的バリアントの検出率は約1.3~1.5 倍向上した3)4)。卵巣癌,卵管癌,腹膜癌患者では,BRCA1/2 以外のHRR 関連の10 遺伝子に病的バリアントが約6%で検出された3)。乳癌患者では,BRCA1/2 以外の乳癌や卵巣癌の易罹患性遺伝子に病的バリアントが3.9%で検出され,他の遺伝性腫瘍原因遺伝子(Lynch 症候群の原因遺伝子のMMR 遺伝子,Li-Fraumeni 症候群の原因遺伝子のTP53 等)に病的バリアントが約0.4%で検出された4)。遺伝性腫瘍の検出率向上とともに,MGPT を実施しなければ乳癌や卵巣癌患者の中の一定割合(患者数を母数とすると数%であるが,BRCA1/2 病的バリアント保持者数比では約1/3~半数相当)で,遺伝性腫瘍の適切な診断や癌易罹患性のリスク評価の機会を逸する可能性があることを示している。乳癌,卵巣癌,膵癌,前立腺患者を対象に8~79 個の遺伝子を搭載したMGPT による生殖細胞系列解析を行ったわが国の報告では,病的バリアントの検出率はBRCA1/2 単独の遺伝学的検査に比べてMGPT では約1.3~2.3 倍向上することが示された5)~8)。HBOC を含む遺伝性腫瘍を疑う症例に対するMGPT では,BRCA1/2 を含むHRR 遺伝子約10~12 個(ATM,BARD1,BRCA1,BRCA2,BRIP1,CHEK2,PALB2,RAD51C,RAD51D,FANCC,FANCM 等Fanconi(ファンコニ)貧血関連遺伝子)とMMR 遺伝子5個(MLH1,MSH2,MSH6,PMS2,EPCAM)に加えて,遺伝性乳癌や遺伝性膵癌の表現型を示す他の遺伝性腫瘍の原因遺伝子(CDH1,PTEN,STK11,TP53 等)を含む20~30 個程度の遺伝子が鑑別診断を備えるうえでは必要と考えられる9)10)。それ以上のサイズの,例えば60~70 個の遺伝子を搭載したMGPT は,遺伝性神経内分泌腫瘍等を含めた幅広い遺伝性腫瘍を鑑別する場合や,がんの既往歴や家族歴からでは特定の遺伝性腫瘍に絞り込めない場合あるいは,家族歴の情報に乏しい場合,家族歴の情報がない場合などでの使用があげられる。リスク評価の参考となるものの現時点では臨床的有用性が明らかではない遺伝子(FAM175A,MRE11A,NBN,XRCC2 等)で病的バリアントが検出された場合には,カンファレンスによる協議を経てからクライエントに結果返却する体制や,今後の新たなエビデンス樹立に向けた症例登録や症例追跡のできる体制下での実施が望まれる。低リスク遺伝子については遺伝子数を増やしても乳癌卵巣癌患者での病的バリアントの検出率の向上は軽微であることがいわれている11)。
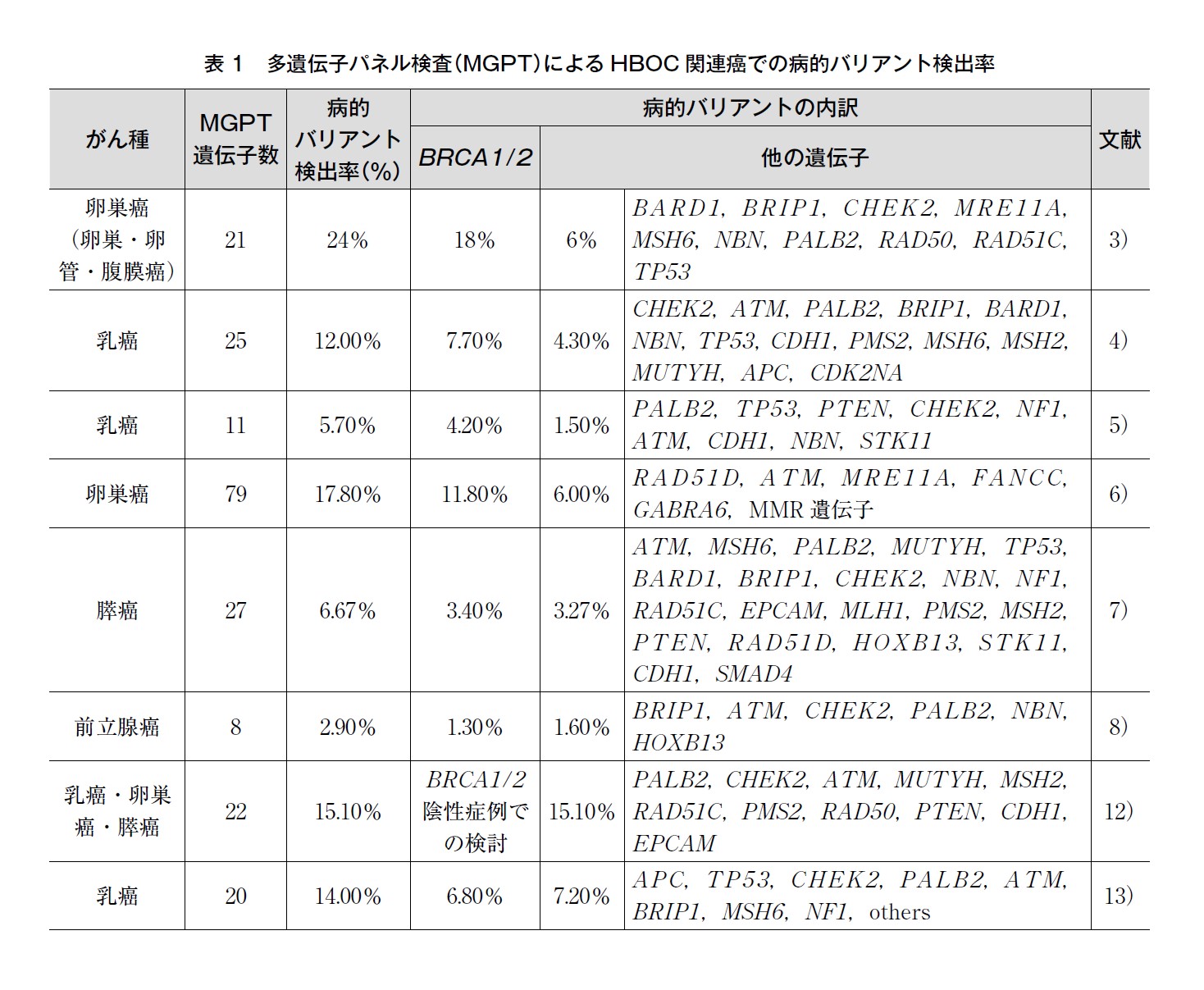
HBOC 関連腫瘍(乳癌,卵巣癌,膵癌)患者でのMGPT の臨床的有用性の報告が,世界の各地域から相次いでいる。わが国でのMGPT を用いたコホート研究では,BRCA1/2 あるいはHRR 遺伝子以外の想定外の遺伝子の例として,乳癌患者においてはCDH1,NF1,PTEN,STK11,TP53 に病的バリアントが約0.5%で検出された。卵巣癌患者や膵癌患者では,HRR 遺伝子(RAD51D,ATM,MRE11A,FANCC)とほぼ同頻度(約3%)でMMR 遺伝子等に病的バリアントが検出された。前立腺癌患者では,HRR 遺伝子(ATM,CHEK2,PALB2,BRIP1,NBN)(約0.9%)とほぼ同頻度(0.8%)で,HOXB3 に病的バリアントが検出された5)~8)。欧州からは,若年発症,多発あるいは多重癌発症の強い個人歴や,第一度近親者に二人以上のがん発症者の家族歴を有する乳癌,卵巣癌,膵癌患者で22 遺伝子搭載のMGPT を用いた検討で,BRCA1/2 野生型の205 症例中31 症例(15.1%)にBRCA1/2 以外の遺伝子(PALB2,CHEK2,ATM,MUTYH,MSH2,RAD51C)の生殖細胞系列病的バリアントが検出された12)。検出率の高い遺伝子はがん種ごとに異なるものの3つのがん種に共通して検出された遺伝子はMUTYH とATM であった。なお,MUTYH のヘテロ接合性病的バリアントに対する乳癌,卵巣癌,膵癌のサーベイランスは,NCCN ガイドラインでは推奨されていない。中東地域からは,乳癌患者1,310症例を対象にした20個の遺伝子搭載のMGPT により184 症例(14.0%)に生殖細胞系列病的バリアントの検出の報告があり,そのうち約半数(90症例,48.9%)はBRCA1 またはBRCA2 の病的バリアントであり,残りの約半数の症例(94症例,51.9%)はBRCA1/2 以外の遺伝子の病的バリアントであった。BRCA1/2 以外に検出頻度の高い遺伝子はAPC,TP53,CHEK2,PALB2 であった13)。HRR 遺伝子やMMR 遺伝子の他,TP53 やAPC 等の他の遺伝性腫瘍の原因遺伝子で高浸透率の遺伝子を解析対象に含むMGPT によって,HBOC をはじめとする遺伝性腫瘍の検出率向上につながることが示唆される。
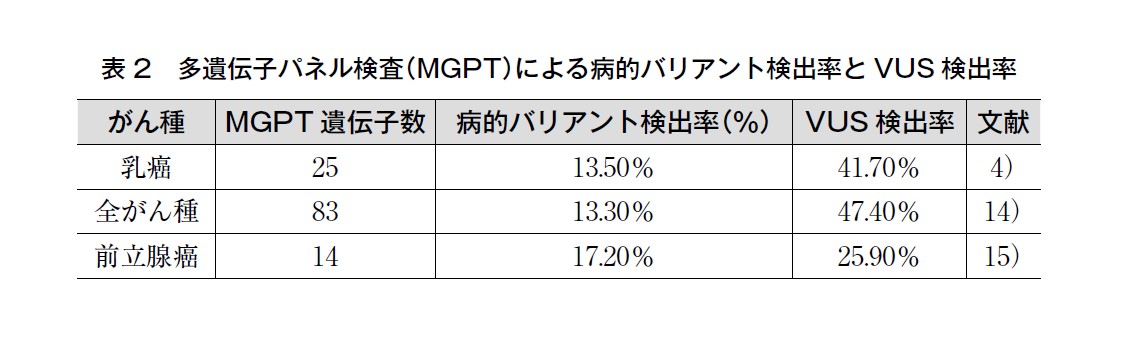
解析遺伝子数の多いMGPT では病的意義不明のバリアント(variant of unknown significance:VUS)検出の頻度が,BRCA1/2 単独の遺伝学的検査より高くなることに留意が必要である。がん種選択のない全がん種患者2,984症例を対象とした83遺伝子のMGPTでは,病的バリアントは13.3%(397/2984)で検出され,VUS は47.4%(1415/2984)で検出された14)。乳癌患者1,781症例で25遺伝子を解析するMGPTでは病的バリアントは13.5%(241/1781)で検出され,VUS は41.7%(742/1781)で検出された4)。前立腺癌患者3,607症例を対象にした14遺伝子のMGPTでは,病的バリアントは17.2%(620/3,607)で検出され,VUS は25.9%(936/3607)で検出された15)。MGPT によるVUS の解釈には人種差の影響も考慮が必要である。遺伝学的検査を受検した5,026症例の乳癌患者対象の大規模コホート解析では,MGPTによるVUSの検出について,黒人やアジア人でのVUS検出率は白人に比べて高かった2)。VUS 検出率は,白人23.7%,黒人44.5%,アジア人50.2%であった。VUS検出時には,MGPTを提供する検査会社へのVUSの根拠の確認や,独自にVUSを解釈できる体制も求められる(遺伝BQ6 を参照)。VUSの検出がBRCA1/2 単独の遺伝学的検査の場合より頻度が増えることは,検査前の遺伝カウンセリングで提供すべき情報である。
MGPT はわが国では保険未収載であり(2024 年5 月時点),クライエントに高額の負担が生じている。検査にかかるコストがMGPT 実施の障壁になることは海外でも指摘がされている16)。複数の遺伝性腫瘍の鑑別を要する場合にはMGPT が,検査のコストと効率性の双方において利点があると考えられる。わが国の保険医療制度下での独特ともいえるMGPT の使い方となるが,術式決定やコンパニオン診断を目的に保険診療のBRCA 遺伝学的検査を先行して,BRCA1/2 病的バリアント陰性の場合に,他の遺伝子のリスク評価のためMGPT を行う方法もある。薬剤選択や術式選択が必要な場合には,結果返却までの期間(turnaround time:TAT)が短いBRCA 遺伝学的検査を先行させることが適切な症例もある。BRCA 遺伝学的検査あるいはMGPT が乳癌,卵巣癌予防に寄与する費用対効果がいわれており17),MGPT の保険収載によっては今後,マクロレベルでの医療費削減の効果が期待される。
HBOC を含む遺伝性腫瘍を疑う癌発症者のクライエントでは,MGPT が理想的な遺伝学的検査となることが望まれる(ただし現時点では保険適用となっていない)。若年発症や両側発症症例等ではMGPT を第一選択とする議論もある。例えば,最近の欧州からの報告では,乳癌,卵巣癌,膵癌患者を対象に22個の遺伝子のMGPT を実施した研究や,両側乳癌患者を対象に22個の遺伝子のMGPTを実施した調査では,MGPT を実施しなければHBOC 関連腫瘍患者の15.1%,HBOC を強く疑う個人歴の乳癌患者の14.4%が適切な遺伝学的診断の機会を逸した可能性が示されている12)18)。
また,BRCA1,BRCA2 の遺伝学的検査の適応となる癌患者では,BRCA1 またはBRCA2 に病的バリアントが検出されるのは33.1%(半数以下)であり,Lynch 症候群の遺伝学的検査の適応となる癌患者でもLynch 症候群の原因遺伝子に病的バリアントが検出されるのは46.2%との報告もある19)。遺伝性腫瘍ごとの遺伝学的検査の検査基準に当てはまっても限定的な遺伝学的検査では適切な遺伝学的診断やリスク評価が得られないケースが半数以上であることを考慮すると,遺伝性腫瘍検出を目的とした遺伝学的検査としてのMGPT の合理性が示唆される。乳癌卵巣癌を予測する疾患リスクモデル(BRCAPRO,CanRisk)やLynch 症候群を予測する計算モデル(PREMM5,MMRpro),多遺伝子でのリスク評価を行うモデル(PREMMplus)も開発されており20)~23),これらの計算モデルも併用した遺伝性腫瘍の予測から,MGPT を行う方法も考えられる。ただし,これらのモデルは東アジア人のデータに由来していないことに注意を要する。
multigene panel testing(MGPT), moderate penetrance genes, risk assessments, non-BRCA, beyond BRCA
二次資料
参考文献
