Ⅱ-3 卵巣癌領域
プラチナ製剤を含む初回薬物療法に奏効したBRCA1/2 病的バリアントを有する進行卵巣癌患者に対し,PARP
阻害薬の維持療法が推奨される。
推奨のタイプ:当該介入の強い推奨
エビデンスの確実性:強,合意率:100%(10/10 名)
推奨の解説:これまでの臨床試験の結果から,プラチナ製剤を含む初回薬物療法に奏効したBRCA1/2 病的バリアントを有する卵巣癌患者に対するPARP 阻害薬の維持療法は無病生存期間を延長し,全生存期間(OS)を延長する傾向にある。一方,管理可能であるものの比較的有害事象が強いこと,高額な薬剤による経済的負担が患者側に生じることを含め,患者と十分話し合ったうえで投薬を検討することが望ましい。
進行卵巣癌(FIGO 分類Ⅲ,Ⅳ期)は予後不良であり,初回薬物療法後に再発するリスクの高い集団であることから,新たな治療オプションが必要とされている。BRCA1/2 病的バリアントを保持するプラチナ感受性再発卵巣癌に対し,オラパリブやニラパリブ,rucaparib,veliparib 等,いくつかのPARP 阻害薬が臨床試験で有効性を示した。その結果から,進行卵巣癌の初回治療において,手術ならびに初回化学療法により奏効の得られたBRCA1/2 病的バリアントを保持する患者に対し,PARP阻害薬を維持療法として投与することの有効性が第Ⅲ相ランダム化比較試験で検証された。PARP 阻害薬の維持療法が推奨されるかを検討する。
本CQ では,BRCA1/2 病的バリアントを保持する卵巣癌患者に対し,PARP 阻害薬の維持療法の介入群と非介入群の2 群間で,「無増悪生存期間の延長」「全生存期間(OS)の延長」「有害事象」「費用」「患者の意向」を評価した。
進行卵巣癌(FIGO 分類Ⅲ,Ⅳ期)に対する初回治療後のPARP 阻害薬の有効性を試みた第Ⅲ相ランダム化比較試験4 編(SOLO-1 試験,PAOLA-1 試験,PRIMA 試験,VELIA 試験)を選択した。いずれの臨床試験も,対象患者の組織型を高異型度漿液性癌,高異型度類内膜癌に限定している。BRCA1/2 病的バリアントを保持する患者のみを対象とした臨床試験はSOLO-1 試験のみで,その他の臨床試験では有効性の解析において生殖細胞もしくは体細胞のBRCA1/2 病的バリアントを保持する症例のサブグループ解析が行われている。「無増悪生存期間の延長」「OS の延長」「有害事象」「費用」「患者の意向」に関して,定性的なシステマティックレビューを行った。
SOLO-1 試験は,Ⅲ,Ⅳ期の高異型度漿液性もしくは類内膜癌で生殖細胞系列BRCA(germline BRCA:gBRCA)1/2 もしくは腫瘍BRCA(tumor BRCA:tBRCA)1/2 の病的バリアントを有する患者で,初回治療として手術,プラチナ製剤を併用した化学療法が行われ完全奏効もしくは部分奏効の得られた患者に対し,オラパリブの維持療法(300 mg,1 日2 回内服を2 年間)とプラセボを比較した第Ⅲ相試験である。オラパリブ維持療法により,3 年無増悪生存割合は60% vs. 27%〔HR:0.30(95%CI:0.23-0.41,P<0.001)〕と非常に高い無増悪生存期間の改善効果が認められた1)。
PAOLA-1 試験は,BRCA1/2 病的バリアントの有無を問わず,Ⅲ,Ⅳ期の高異型度漿液性もしくは類内膜癌の患者を対象とし(粘液性癌を除くBRCA1/2 病的バリアントを保持する非漿液性癌を含む),初回治療として手術,ベバシズマブを併用した化学療法が行われ完全奏効もしくは部分奏効の得られた患者に対し,維持療法としてオラパリブ2 年間内服およびベバシズマブ15 カ月の併用療法と,プラセボとベバシズマブ併用療法を行うことの第Ⅲ相試験である。無増悪生存期間について,全体集団においてHR:0.59,さらにBRCA1/2 病的バリアントを保持するサブグループにおいては,無増悪生存期間中央値は37.2 カ月vs. 21.7 カ月〔HR:0.31(95%CI:0.20-0.47)〕と,オラパリブ+ベバシズマブ維持療法により高い予後改善効果を認めた2)。
PRIMA 試験は,BRCA1/2 病的バリアントの有無を問わず,Ⅲ,Ⅳ期の高異型度漿液性もしくは類内膜癌の患者を対象とし,初回治療として手術,プラチナ製剤を併用した化学療法が行われ完全奏効もしくは部分奏効の得られた患者に対し,ニラパリブの維持療法(300 mg,1 日1 回内服を3 年間)とプラセボを比較した第Ⅲ相試験である。全体集団においてHR:0.62,さらにBRCA1/2 病的バリアントを保持するサブグループにおいては,無増悪生存期間中央値は22.1 カ月vs. 10.9 カ月〔HR:0.40(95%CI:0.27-0.62)〕と,ニラパリブ維持療法により予後改善効果を認めた3)。
VELIA 試験は,BRCA1/2 病的バリアントの有無を問わず,Ⅲ,Ⅳ期の高異型度漿液性癌の患者を対象とし,初回治療としてカルボプラチン+パクリタキセル(TC)療法を行う群,TC 療法にveliparib(本邦未承認)を併用する群,TC 療法にveliparib を併用しかつveliparib 維持療法を行う群の3 群を比較した第Ⅲ相試験である。BRCA1/2 病的バリアントを有するサブグループにおいて,TC 療法にveliparib を併用しかつveliparib 維持療法を行う群とTC 療法のみを行う群を比較した結果,無増悪生存期間中央値は34.7 カ月vs. 22 カ月〔HR:0.44(95%CI:0.28-0.68,P<0.001)〕と予後改善効果が認められた4)。
ATHENA 試験は,BRCA1/2 病的バリアントの有無を問わず,Ⅲ,Ⅳ期の高異型度上皮性癌の患者を対象とし,初回治療として手術,プラチナ製剤を併用した化学療法が行われ完全奏効もしくは部分奏効の得られた患者に対し,rucaparib(本邦未承認)の維持療法(600 mg,1 日2 回を2 年間)とプラセボを比較した第Ⅲ相試験である。全体集団においてHR:0.52,さらにtBRCA1/2 病的バリアントを保持するサブグループにおいて無増悪生存期間中央値は未到達vs. 14.7 カ月〔HR:0.40(95%CI:0.21-0.75)〕と,rucaparib 維持療法により予後改善効果が認められた5)。
いずれの試験も対象患者の組織型が限定されている。無増悪生存期間に関して,VELIA 試験はgBRCA1/2 病的バリアントを保持する症例のサブ解析のデータ,PRIMA 試験,PAOLA-1 試験,ATHENA 試験はtBRCA1/2 病的バリアントを保持する症例のサブ解析のデータである。SOLO-1 試験,PAOLA-1 試験,PRIMA 試験,ATHENA 試験は,化学療法終了後の維持療法としてPARP 阻害薬を使用している。VELIA 試験はPARP 阻害薬を化学療法と併用した後,維持療法としても使用している。また,維持療法におけるPARP 阻害薬の内服期間は,SOLO-1 試験,PAOLA-1 試験,VELIA試験,ATHENA 試験においては2 年間,PRIMA 試験では3 年間である。各試験により対象とする組織型が異なること,維持療法の試験デザインが異なることから,アウトカムに対する非直接性はあると判断した。しかし,いずれのランダム化比較試験においても無増悪生存期間の延長効果は一貫しており,無増悪生存期間の延長に対するエビデンスの確実性は強とした。
SOLO-1 試験の7 年後のOS データが発表された。経過観察期間の中央値はオラパリブ群88.9 カ月,プラセボ群87.4 カ月であった。OS 中央値は未到達vs. 75.3 ヵ月〔HR:0.55(95%CI:0.40-0.76,P=0.004)〕とオラパリブ維持療法により高い予後改善効果が認められたが,統計学的には有意ではなかった(統計学的に有意とするにはP<0.001 が必要)6)。また,その他のランダム化比較試験は解析時のdata maturity が低く,OS に関して十分な統計解析が行われていないため非一貫性は評価できないと判断した。以上より,OS 延長に対するエビデンスの確実性は弱とした。
有害事象の発生率は,PAOLA-1 試験,PRIMA 試験,VELIA 試験,ATHENA 試験ではBRCA1/2 病的バリアントを保持しない患者も含めたデータである。PARP 阻害薬による有害事象は,いずれの試験においてもほぼ全例で認められている。主な有害事象には,骨髄抑制,疲労,消化管毒性がある。いずれの有害事象も休薬や投与量の減量により管理可能であったが,投与中止例はSOLO-1 試験では11.5%,PAOLA-1 試験では20%,PRIMA 試験では12%,VELIA 試験では19%,ATHENA 試験では11.8%であった。また,頻度が低いものの重篤な有害事象に白血病/骨髄異形成症候群がある。有害事象に関して一貫性は認めるが,SOLO-1 試験以外の試験がBRCA1/2 病的バリアントを保持しない患者も含めたデータであるため有害事象に対するエビデンスの確実性は中とした。
SOLO-1 試験のデータに基づいたオラパリブとPRIMA 試験のデータに基づいたニラパリブに関しては,費用対効果についても検討がなされており,いずれの研究においてもPARP 阻害薬の維持療法はcost effective とされている。PRIMA 試験ではBRCA1/2 病的バリアントを保持する患者以外も対象となっており,さらに評価方法や評価を行っている国も異なるため,費用対効果に対するエビデンスの強さは弱とした。
VELIA 試験ではgBRCA1/2 病的バリアントを有する症例のサブ解析のデータ,PRIMA 試験,PAOLA-1 試験,ATHENA 試験ではBRCA1/2 病的バリアントを保持しない患者も含めたデータである。SOLO-1 試験を含めた5 つの試験においていずれの試験においても介入群と対照群とでQOL の差を認めなかった。しかし,それぞれの試験で評価方法や評価時期が異なるため,患者の意向に対するエビデンスの確実性は弱とした。
プラチナ製剤を含む初回薬物療法に奏効した卵巣癌患者に対するPARP 阻害薬の維持療法の効果を検証した第Ⅲ相試験は5 つあり,いずれの試験も組織型を限定している,試験デザインが異なる,SOLO-1 試験以外はBRCA1/2 病的バリアントを保持しない症例を含んでいる等,アウトカムに対する非直接性を認める。無増悪生存期間の延長効果は,SOLO-1 試験においても,その他の試験のBRCA1/2 病的バリアントを保持する症例を対象にしたサブグループ解析においても,一貫して認められ,エビデンスの確実性は強いと考えられる。OS の延長効果については,SOLO-1 試験において高い改善効果を認めるものの統計学的に有意ではない,その他の試験の結果が発表されていないため非一貫性が評価できない,といった点からエビデンスの確実性は弱いと考えられる。患者の意向に関しては,いずれの試験においても介入群と非介入群の間に有意なQOL の差はみられなかったが,評価方法や評価時期がそれぞれで異なるため,エビデンスの確実性は弱いと考える。
害のアウトカムに対しても益のアウトカムと同様の理由で非直接性を認める。PARP 阻害薬の維持療法による有害事象はいずれの試験においても,ほぼ全例で認められたが有害事象は休薬や投与量の減量により管理可能であった。結果に非一貫性を認めないことからエビデンスの確実性は中と考える。
本CQ が優先事項かについては9 名が「はい」と回答したが,1 本CQ の推奨決定会議参加対象委員12 名の内訳は,乳癌領域医師2 名,婦人科領域医師2 名,遺伝領域医師2 名,遺伝看護専門看護師1 名,認定遺伝カウンセラー2 名,患者・市民3 名であった。推奨決定会議の運営にあたっては,事前に資料を供覧し,参加対象委員全員がEvidence to Decision フレームワークを記入して意見を提示したうえで,当日の議論を行った。推奨決定会議には参加対象委員のうち,10 名が参加した。
本CQ が優先事項かについては9 名が「はい」と回答したが,1 名は「卵巣がん・卵管癌・腹膜癌治療ガイドライン」に記載するのであればそちらが優先されるべきで,将来的には臓器横断的な項目設定が望ましい,との回答であった。

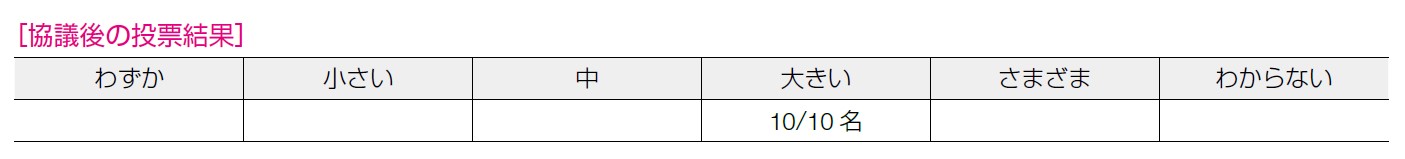
10 名全員が「大きい」の回答であった。卵巣癌が難治性のがんであることを考えても無増悪生存期間の延長効果は高く,望ましい効果が大きいと考えられる。
介入の望ましくない効果について「中」が7 名,「小」が3 名であった。有害事象はコントロール可能なものが多いが,致死的な有害事象として二次性の血液がんもあり,注意深いフォローが必要である点,減量や休薬期間の延長を要する頻度も一定程度存在する点が指摘された。

10 名全員が「強」の回答であった。第Ⅲ相ランダム化比較試験で検証されており,エビデンスの質はいずれの試験も高いと考えられた。

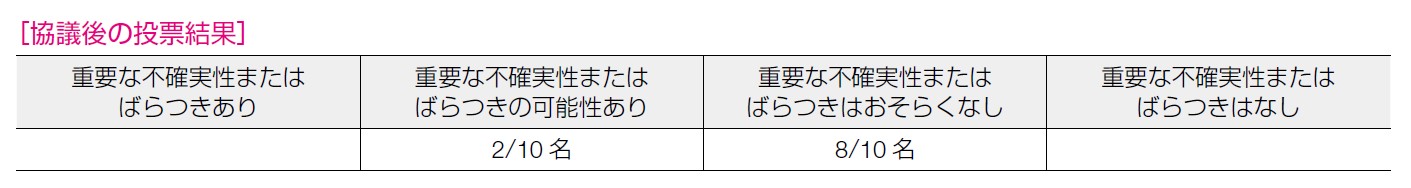
2 名が「重要な不確実性またはばらつきの可能性あり」と回答し,8 名が「重要な不確実性またはばらつきはおそらくなし」と回答した。維持療法の対象,予後延長効果は明らかであり不確実性は少ないのではないかという意見のほか,費用に対する考え方には個人差がある点が指摘された。
9 名が「おそらく介入が優位」,1 名が「介入が優位」の回答であった。望ましい効果としては大きいが,様々な有害事象,経済的負担,全生存期間データが未成熟である点等が指摘された。

9 名が「おそらく介入が優位」,1 名が「介入が優位」の回答であった。SOLO-1 試験のデータに基づいたオラパリブとPRIMA 試験のデータに基づいたニラパリブに関しては,いずれもPARP 阻害薬の維持療法はcost effective とされている。必ずしもわが国のデータでなく,海外のデータから判断してよいことが確認された。

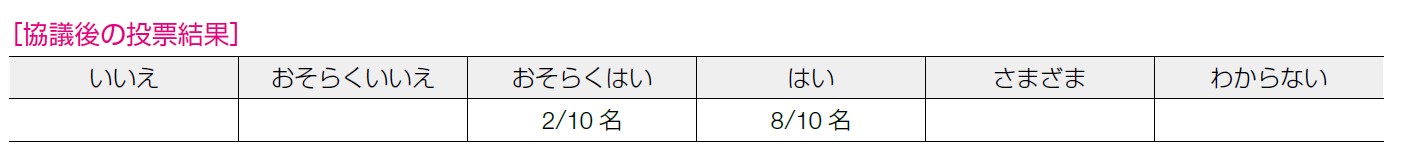
2 名が「おそらくはい」,8 名が「はい」の回答であった。無憎悪生存期間の改善効果が高いこと,懸念となる有害事象は管理可能であること,費用対効果も見込まれることがあげられた。
3 名が「おそらくはい」,7 名が「はい」の回答であった。広く用いられている薬剤ではあるが,異なる用量の薬剤がいずれも揃っている薬局を探すのに苦労する等,入手が容易でない場合があることが指摘された。

1 回目の投票では,5 名が「当該介入の条件付きの推奨」,5 名が「当該介入の強い推奨」の回答であった。そのため,どのような点で「条件付き」が考慮されるかが議論された。
有害事象への対応,費用負担,遺伝診療の必要性について意見があった。難治性の病態であること,HR が非常に良好で予後改善が期待されること,有害事象は許容範囲(多くの有害事象は管理可能)と判断されること,費用対効果も期待できること,遺伝カウンセリングは病院間の連携でクリアできると考えられることがそれぞれ確認された。
以上の議論を踏まえ,2 回目の投票の結果,10 名全員が「当該介入の強い推奨」と回答した。

ASCO*ガイドラインでは,オラパリブ,ニラパリブ,オラパリブ+ベバシズマブ併用療法,rucaparibについて,治療を強く推奨としている7)。
NCCN ガイドラインは,プラチナ製剤を含む初回薬物療法に奏効したBRCA1/2 病的バリアントを有する卵巣癌患者に対するオラパリブ,ニラパリブ,オラパリブ+ベバシズマブ併用療法による維持療法をカテゴリー1 で推奨しているが,veliparib については記載はない8)。
ASCO:American Society of Clinical Oncology
該当なし。
バリアントの多様性と薬効との関連について今後の評価を継続することが勧められる。
外部評価では内容に関する大きな指摘はなかった。
BRCA,PARP inhibitor,maintenance,cost,patient preference
文献検索式,エビデンス総体評価シート,システマティックレビューレポート,Evidence to Decisionフレームワークは,JOHBOC ホームページに掲載。
