第一度近親者:同胞,両親,子,第二度近親者:おじおば,祖父母,孫,おいめい,第三度近親者:いとこ,大おじ大おば
NCCN:National Cancer Comprehensive Network
(1) 年 齢
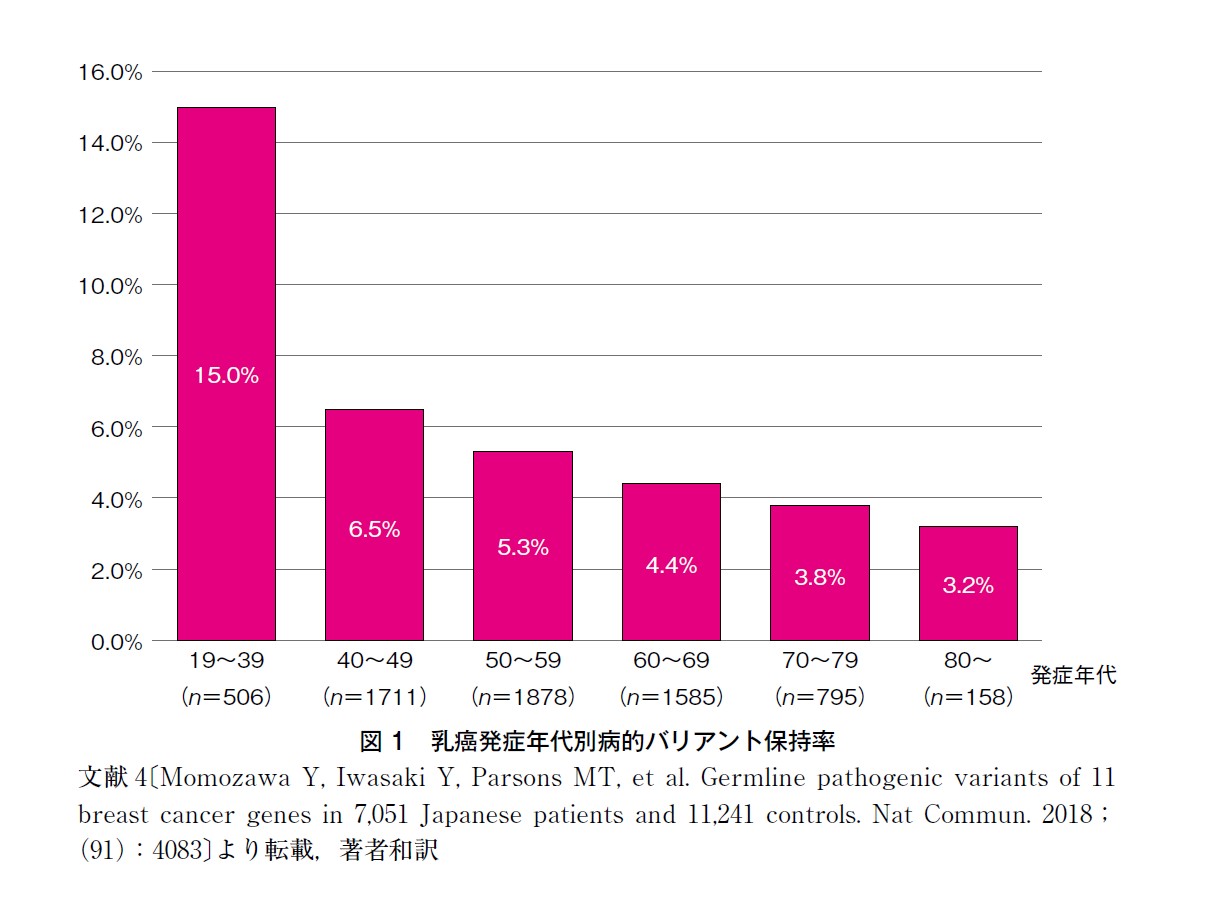
NCCN ガイドラインでは,BRCA1/2 の検査基準として45 歳以下での乳癌発症としていたが,現在,高浸透性乳癌関連遺伝子(特にBRCA1,BRCA2,CDH1,PALB2,PTEN,TP53)の検査基準を提示しており,乳癌既発症者に対しては50 歳以下としている(表1)1)。Myriad の98,979 人の乳癌患者データでは,乳癌ハイリスク7 遺伝子(BRCA1,BRCA2,PALB2,TP53,PTEN,CDH1,STK11)の年代別病的バリアント保持率は,26~30 歳が最も高く31.8%,31~35 歳13.4%,36~40 歳13.4%,41~45 歳8.4%,46~50 歳5.3%,51~55 歳4.1%と年齢を追うごとに減少した3)。ただし,高齢であっても乳癌発症は対照群より約5倍高く,遺伝性腫瘍関連遺伝子の寄与は若年にとどまらない。 Momozawa らの報告では,バイアスのない日本人乳癌女性における,乳癌ハイリスク11遺伝子の病的バリアント保持率は,39 歳以下15.5%,40 代6.5%,50 代5.3%,60 代4.4%で,BRCA1/2 の病的バリアント保持率は,49 歳以下で2,217 人中149 人(6.7%),50 歳以上で4,416 人中133 人(3.0%)であった(図1)4)。 ASCO*では,65 歳以下のT1-3 乳癌患者と,条件つきの65 歳以上乳癌患者に対して,BRCA 遺伝学的検査を推奨しており,その結果感度は98%になったと報告している。これまで,検査適応基準の閾値を10%前後の病的バリアント保持率として考慮しガイドラインが作成されることが多かったが,その判断基準に変化を認めた5)。また,ASBrS*では,全年齢における病的バリアント保持者のうち,13.1%がNCCN ガイドラインクライテリアに合致していないため,年齢問わず乳癌既往者すべてがBRCA1/2 やPALB2 を含む乳癌関連遺伝子検査を受けられるようにするべきと勧告している。しかしながら,検査対象者の増加により,費用の増大,遺伝カウンセリング等の検査体制への影響,高齢者の臨床的有用性等,検討すべき課題も指摘されている6)。 海外では遺伝学的検査受検前のリスク評価として,疫学データを用いたBRCA1/2 病的バリアント保持予測モデルが汎用されており,カットオフ値を 10%としたものがBRCA 遺伝学的検査の検査基準の1つとして従来使用されていた。 わが国ではこのような疫学データに基づくリスクモデルが存在しないため,日本人乳癌とがん非罹患者の大規模症例対照研究の結果を参考に,年齢のカットオフ値を45 歳と設定した。 年齢基準については,他ガイドラインの状況や国内での病的バリアント保持率・費用対効果等を吟味のうえ,わが国でも今後基準の見直しを予定している。ASCO:American Society of Clinical Oncology
ASBrS:The American Society of Breast Surgeons

(2) サブタイプ
HBOC コンソーシアムのデータベースでは,BRCA1 病的バリアント保持者ではトリプルネガティブ乳癌(triple-negative breast cancer:TNBC)の発症が多く75.8%を占め,BRCA2 病的バリアント保持者では,luminal タイプが64.4%と多く,各々特徴がある7)。 実際に家族歴がないTNBC 患者において,BRCA1 病的バリアント保持率は,30~29 歳で21.1%,40~49 歳で7.4%,50~59 歳5.6%,60 歳以上は0%であった。luminal タイプ乳癌患者では,BRCA2 病的バリアント保持率は,29 歳以下が4.5%,30~39 歳6.1%,40~49 歳2.8%,50~59 歳2.6%,60 歳以上は0%であった8)。(3) 多発乳癌
Myriad 社のデータ98,979 人の乳癌患者のうち10,220 人(10.3%)が多発乳癌患者で,その病的バリアント保持率は,BRCA1 が4.23%,BRCA2 が3.61%であり,単一乳癌患者と比較し有意に高かった〔BRCA1 はオッズ比(odds ratio:OR):1.96(95%CI:1.70-2.23),BRCA2 はOR:1.64(95%CI:1.42-1.89)〕3)。 HBOC コンソーシアムのデータベースでは,登録乳癌患者全体におけるBRCA1/2 いずれかの病的バリアント保持率は19.7%であったが,多発乳癌患者では,BRCA1 が40%,BRCA2 は18%であった7)。 乳癌診断後,20 年間の対側乳癌の推定累積リスクは,BRCA1 で40%,BRCA2 で26%であった9)。(4) 卵巣癌,卵管癌および腹膜癌発症
HBOC における卵巣癌,卵管癌および腹膜癌発症リスクが高いことは既知である。乳癌既発症者の場合,BRCA1/2 病的バリアント保持率は,50 歳未満で4.7%,50 歳以上で2.2%に比べ,卵巣癌も重複発症すると50歳未満で 26.3%,50歳以上で 12.1%と格段に保持率が高い10)(卵巣癌 CQ1 参照)。(5) 膵 癌
膵癌患者のうち2.5~5%で,BRCA2 病的バリアントを保持する11)12)。 膵癌はBRCA1/2 関連腫瘍の1 つとして考えられており,膵癌と診断されたすべての患者にBRCA 遺伝学的検査は意義がある。(6) 男性乳癌
Momozawa らの研究では,BRCA1/2 を含む乳癌関連遺伝子の病的バリアントを男性乳癌患者53 例中13 例(24.5%),男性対照者12,490 例中129 例(1.0%)で同定している〔OR:31.1(P=1.64×10-14)〕。女性乳癌患者より男性乳癌患者は女性乳癌患者よりも病的バリアント保持率が有意に高く〔OR:5.3(P=7.93×10-6)〕,BRCA2 の病的バリアントの保持率は男性乳癌と有意に関連していた[男性乳癌18.9%,対照群0.2%〔OR:111.2(P=1.73×10-16)〕](表2)4)。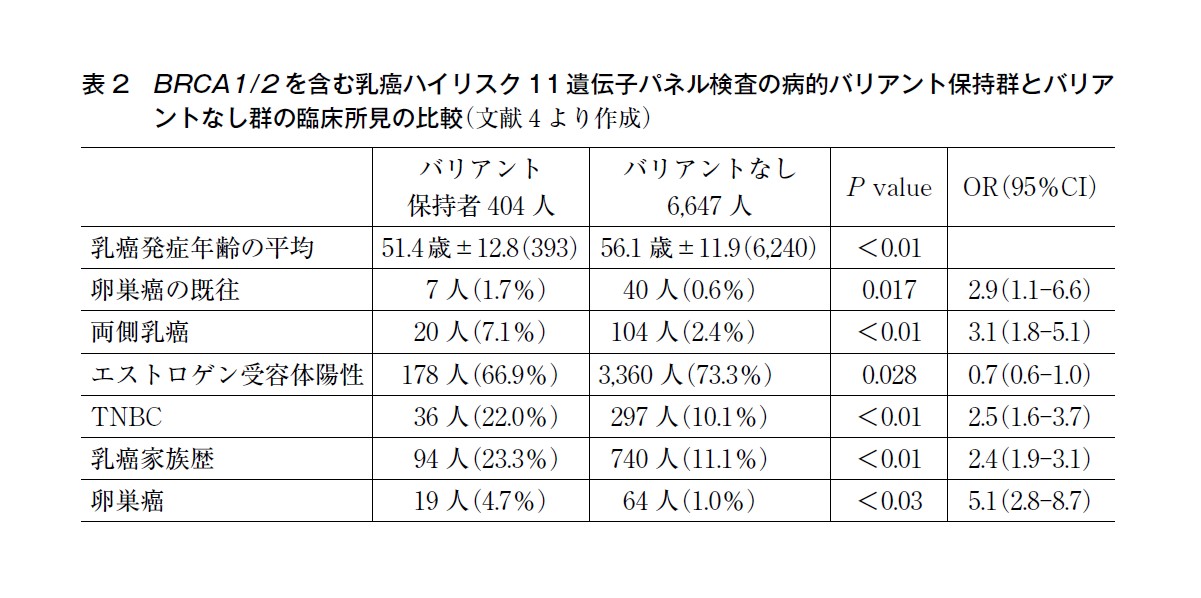
(1) 手術不能・転移再発薬物療法
OlympiAD 試験は,アンスラサイクリン系およびタキサン系の治療歴を有し,生殖細胞系列にBRCA1/2 病的バリアントを保持する302 例のHER2 陰性転移性乳癌を対象とし,オラパリブ群と標準療法群を比較した国際共同第Ⅲ相試験である15)(治療推奨については乳癌CQ7 参照)。 この結果をもって,アントラサイクリン系抗悪性腫瘍薬およびタキサン系抗悪性腫瘍薬を含む治療歴を有する,BRCA1/2 病的バリアントを保持し,かつHER2 陰性の手術不能または再発乳癌に対して,PARP 阻害薬の1 つであるオラパリブの使用が保険収載された。(2) 再発高リスク乳癌術後薬物療法
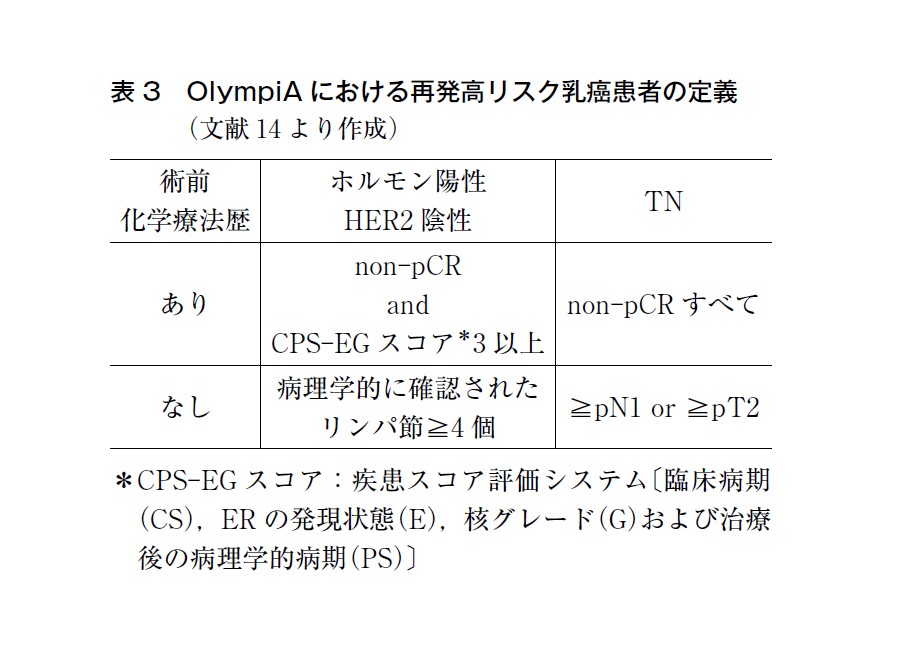
OlympiA 試験は,生殖細胞系列にBRCA1/2 病的バリアントを保持し,かつHER2 陰性の再発高リスク早期乳癌患者1,836 例を対象に,オラパリブ群とプラセボ群を比較した国際共同第Ⅲ相試験である16)(治療推奨については乳癌CQ8 参照)。 この結果をもって,BRCA1/2 病的バリアントを保持し,かつHER2 陰性で再発高リスクの乳癌における術後薬物療法としてオラパリブが保険収載された。臨床試験に組み込まれた再発高リスクの定義や背景等を熟知したうえで,適応患者の選択を行うことが望ましい。OlympiA の適応基準は表3 に示す。