Ⅱ-5 膵癌領域
膵癌リスクを有する生殖細胞系列病的バリアント保持者に対して有用な膵サーベイランスの方法は?
膵癌のリスクとなるBRCA1/2 を含めた生殖細胞系列病的バリアント保持者に対して,超音波内視鏡(EUS)とMRI/磁気共鳴胆管膵管撮影検査(MRCP)を用いた膵サーベイランスが望まれる1)2)。造影CT や腹部超音波を用いてもよい1)。初回は膵管系の描出に優れるMRI/MRCP と膵実質を観察するための他の画像検査(腹部超音波,EUS,造影CT)を併用し,膵酵素と腫瘍マーカーを含んだ血液検査を行う。その後はいずれかの画像検査と血液検査を行い,異常所見や変化が出現してないか観察する。サーベイランス間隔は他のリスク因子も考慮して,6~12 カ月ごとに行う。高リスクの遺伝子バリアントやその他のリスク因子を有する場合には50 歳未満でサーベイランスを開始することも考慮する。
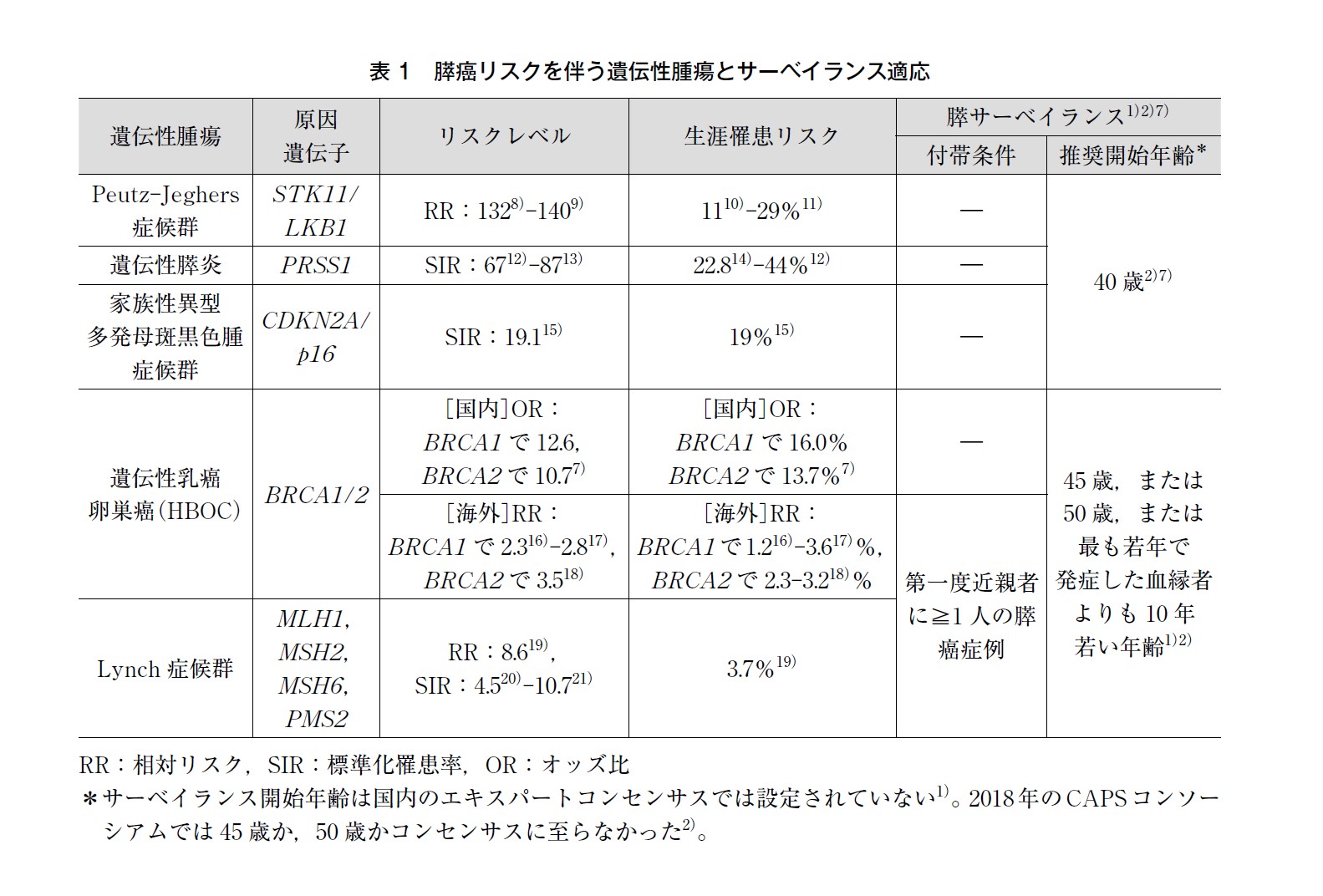
BRCA1/2 を含む様々な遺伝子の病的バリアントによって膵癌のリスクが上昇することが報告されている。STK11(Peutz-Jeghers(ポイツ・ジェガース)症候群),PRSS1(遺伝性膵炎),CDKN2A/p16(家族性異型多発母斑黒色腫症候群),BRCA1/2(HBOC)やミスマッチ修復遺伝子(Lynch(リンチ)症候群)等が主な膵癌リスク遺伝子であるが,そのリスクレベルは様々である。1994 年に設立された米国Johns Hopkins 大学のNational Familial Pancreas Tumor Registry(NFPTR)を皮切りに,単施設,多施設共同あるいは多国間国際共同の家族性膵癌登録制度が設立され,それらを母体に基礎・臨床両面での研究がなされてきた3)。NFPTR を母体としたInternational Cancer of the Pancreas Screening(CAPS)Consortium には数年毎に国際的エキスパートが集い,膵癌ハイリスク対象者のサーベイランスについて討論されている2)。国内では2014 年に家族性膵癌登録制度4)が発足され,2020 年に欧米のデータをもとにした家族性・遺伝性の膵癌リスク保有者に対するサーベイランスのエキスパートコンセンサス1)が発表され,現在は多施設共同サーベイランス研究(Diamond study)5)が進行中である。したがって,本BQ に関する国内のデータ集積は少なく,現時点ではほとんどのエビデンスを欧米のデータから引用せざるを得ないが,近年になりわが国におけるBRCA1/2 病的バリアント保持者における膵癌リスクに関する研究結果が報告され始めている6)。
遺伝性腫瘍における膵癌リスクレベルと膵のサーベイランス適応について表1 に記す。CAPS2)7)や国内のコンセンサス1)では膵癌の相対リスク5 以上,または生涯リスク5%以上をサーベイランス対象としている。海外ではBRCA2 病的バリアント保持者というだけでは相対リスクは3~4 倍と報告されるため「第一度近親者に膵癌症例がいる場合」という条件付きでサーベイランスの対象とされ,BRCA1 病的バリアント保持者に関しては膵癌リスクの上昇は軽度であったためコンセンサスには至らなかった。しかし,近年の国内の大規模症例対照研究ではBRCA1 病的バリアント保持者もBRCA2病的バリアント保持者とほぼ同等のリスクであり,サーベイランスの基準値を優に超えたリスクレベルが報告されている〔85 歳の罹患頻度:BRCA1 16.0%(95%CI:-3.9-32.1),BRCA2 13.7%(95%CI:3.7-22.8)6)。このため,現時点では,わが国のBRCA1/2 病的バリアント保有者は膵癌の家族歴がなくてもサーベイランス対象に含めるべきとも考えられる。今後さらなる研究データの蓄積が期待される。
画像検査と膵酵素や腫瘍マーカー等を含んだ血液検査を用い,6~12 カ月毎に経過観察することが提案されている1)2)。欧米では放射線被曝を有する造影CT や,肥満や消化管ガスにより検査不良域が発生しやすい腹部超音波は敬遠され,小腫瘤の検出に優れている超音波内視鏡(endoscopic ultrasonography:EUS)22)23)と被曝がなく膵管の描出に優れているMRI/MRCP(MRCP を含む腹部MRI。造影剤は用いなくてよい)が標準的とされているが2),日本人は欧米人より痩せているため腹部超音波が多用されていることや,日本では造影CT が内科/外科共通で頻用される画像ツールであること等から,腹部超音波や造影CT も提案されている1)。しかし短所として,EUS では鎮静剤を要することや,稀ながら穿孔のリスクがあること(0.03~0.15%),MRI では閉所恐怖症には適さないことや,撮像時間を要するため症例数が限られること,腹部超音波では消化管ガスや肥満等の影響により検査不良域が生じること,造影CT ではヨードアレルギーや腎障害を有する症例には適さないこと等があげられる。特にCT の放射線被曝による生殖細胞系列病的バリアント保持者における発がんリスク上昇が懸念されるため,慎重に判断する必要がある1)。他臓器の術後経過観察目的あるいは他のリスク臓器のサーベイランス目的で行われる画像検査の観察範囲を膵まで広げる等の工夫も,患者負担の軽減やコストベネフィットの観点から推奨される。
微小な膵癌を画像だけで診断することが困難なことから,サーベイランスで膵管狭窄や膵腫瘤,限局性膵萎縮22)23)など悪性を疑う所見が認められた場合には,病理診断も必要になる。膵管系の変化が主体である場合は内視鏡的逆行性胆管膵管造影(endoscopic retrograde cholangiopancreatography:ERCP)や内視鏡的鼻膵管ドレナージ(endoscopic nasopancreatic drainage:ENPD)を用いた膵液細胞診が提案されているが,検査に伴う膵炎のリスクがある24)。また,膵腫瘤が認められる場合にはEUS ガイド下針穿刺吸引法が提案されるが,小型病変では正診率が低下することや(≧10 mm の病変:97%,<10 mm の病変:64%)25),稀ながら穿刺路播種の合併症が報告される(経十二指腸穿刺より経胃穿刺の際に多く認める:0% vs. 0.86%)26)。これらの情報を患者,家族,内科医,外科医らの間で十分に事前共有し,方針を決めていく必要がある。
膵癌の遺伝性リスク保持者を対象としたサーベイランス研究では,2018 年に2 編のメタ解析が報告されている。Signoretti ら27)は高度異型膵管内腫瘍(High-grade PanIN3),膵管内乳頭粘液性腫瘍(intraductal papillary mucinous neoplasm:IPMN),切除可能R0 膵癌を標的病変としたEUS とMRIによるサーベイランス研究のうち2017 年6 月までに英文報告されたものをメタ解析した。全リスク保持者1,588 例のうち95 例(6%)に手術適応を認め,3.3%に標的病変を認めている。標的病変は,Peutz-Jeghers 症候群の12.2%,遺伝性乳癌卵巣癌(HBOC)の6.3%,家族性黒色腫の5%,遺伝性膵炎の3.3%,家族性膵癌の3%に認められた。Paiella ら28)もほぼ同様の標的病変の条件で2000 年1 月~2016年12 月の英文論文をメタ解析し,1,551 例のリスク保持者のうち1.8%に標的病変を認めたとしている。しかしながら,サーベイランス対象の1%が進行膵癌で診断されたこと27)や,膵切除した症例のうち68%が本来は切除する必要がなかった病変であったこと28)を負の結果として報告している。一方で,2022 年の米国多施設共同研究(CAPS 研究)では,1,731 人の膵癌リスク保持者(23%がBRCA1/2病的バリアント)をEUS とMRI を用いて中央値2.8 年サーベイランスしたところ,26 例の膵癌と13例の高度異型膵管内腫瘍を認めた。サーベイランス中に診断された症例ではStageⅠ 58%,5 年生存率73%,生存期間中央値9.8 年なのに対して,サーベイランスしなかった/やめた症例ではStageⅠ 14%,5 年生存率0%,生存期間中央値1.5 年で,いずれも有意差を認めたと報告しており,今後が期待される結果であった29)。
第一度近親者に複数の膵癌症例がいる家族性膵癌家系やBRCA1/2 病的バリアント保持者では,遺伝カウンセリング,遺伝学的診断,膵サーベイランス等の過程でアンケートによる精神面の変化を評価する研究が行われてきた。サーベイランスを希望される人は家族に膵癌を有する人(75% vs. 55%)や膵癌に対する不安を抱いている人(72% vs. 47%)の比率が多い30)。彼らがサーベイランスに参加するモチベーションとなっているものは,膵癌の早期診断や前癌病変の診断への期待,膵癌リスクを低減させるための情報の取得31),医学への貢献の意識32)等である。家族性膵癌家系とそうでないBRCA2 病的バリアント保持者を比較した場合には,膵癌リスクを自覚している頻度に差がある(42% vs. 15%)33)。サーベイランス参加者は当初膵癌に関する強迫観念や不安を感じているが,3 カ月~3 年のサーベイランスで有意に軽減されることが報告されている32)34)。一方で,ドイツの家族性膵癌登録制度(FaPaCa)はリスク対象者286人にサーベイランスを推奨したが,49%しか参加しなかったことを報告しており,参加者が少なかった理由としてサーベイランスによる精神的負担よりむしろ医療機関を受診するための時間や費用が負担になっていることを指摘していた35)。
pancreatic cancer,risk,BRCA variant,screening,surveillance
