Ⅱ-2 乳癌領域
BRCA1/2 病的バリアントを保持する転移再発乳癌に対し,PARP 阻害薬の投与を条件付きで推奨する。
推奨のタイプ:当該介入の条件付きの推奨
エビデンスの確実性:中,合意率:77%(7/9 名)
推奨の解説:推奨決定会議では「当該介入の条件付きの推奨」とした理由として,アンスラサイクリン系薬剤およびタキサン系薬剤既治療のHER2 陰性乳癌のみを対象としていること,生存期間延長のデータがないこと,費用対効果が明らかではないこと,PARP 阻害薬による二次性悪性腫瘍発現が報告されていることが挙げられた。
乳癌のうち5%程度の症例はBRCA1/2 病的バリアントを保持する。これらの乳癌は,PARP 阻害薬やプラチナ製剤に感受性が高い。これは相同組換えによるDNA 二本鎖切断修復能が低下しているためである。PARP はDNA 一本鎖切断の塩基除去を修復し,PARP 機能が抑制されるとDNA 一本鎖切断が蓄積されて,DNA 二本鎖切断が生じる。BRCA1/2 病的バリアントのある細胞ではDNA 二本鎖切断が修復されないため,PARP 阻害薬により合成致死が誘導される。この背景より,BRCA1/2病的バリアントを保持するHER2 陰性転移再発乳癌患者に対するPARP 阻害薬の意義を検討した。
ちなみに,わが国ではPARP 阻害薬として2018 年7 月にオラパリブが,2024 年1 月にタラゾパリブが承認されている。
本CQ ではPARP 阻害薬を含む治療群と含まない治療群の2 群間で,「全生存期間(overall survival:OS)」「無増悪生存期間」「有害事象」「QOL」「費用対効果」「患者の意向」「患者満足度」を評価した。
本CQ に対する文献検索の結果,PubMed 403 編,Cochrane 125 編,医中誌51 編が抽出され,計579 編がスクリーニング対象となった。2 名のシステマティックレビュー委員が独立して計2 回の文献スクリーニングを行い,抽出された27 編がシステマティックレビューの対象となった。
介入研究16 編,観察研究7 編,観察研究の統合解析4 件を採択した。「全生存期間(OS)」「無増悪生存期間」「有害事象」「QOL」「費用対効果」「患者の意向」「患者満足度」に関して定性的なシステマティックレビューを行った。
PARP 阻害薬に関しては,第Ⅱ相,第Ⅲ相試験が選択され,オラパリブを対象としたOlympiAD 試験1),タラゾパリブを対象としたEMBRACA 試験2),ニラパリブを対象としたBRAVO 試験3)があるが,ニラパリブに関してはわが国では乳癌に対し保険適用外である。また,転移性乳癌に対する化学療法未治療集団において,カルボプラチンとパクリタキセル併用療法にveliparib(本邦未承認)の上乗せを検討する試験があるものの,わが国では標準治療ではない併用化学療法をバックボーンとしているため非直接性が著しい4)。他のランダム化比較第Ⅱ相試験では併用療法が非標準的なもの〔テモゾロミド(保険適用外),カルボプラチン,パクリタキセル〕であり,非直接性が著しい5)6)。
ランダム化第Ⅲ相試験として,OlympiAD 試験1),EMBRACA 試験2),BRAVO 試験3)について,複数の報告があるが,いずれもOS を延長する傾向はみられたが,統計学的に有意ではなかった。〔OlympiAD 試験ではHR:0.98(95%CI:0.54-1.78),EMBRACA 試験ではHR:0.87(95%CI:0.67-1.073),BRAVO 試験ではHR:0.95(95%CI:0.63-1.42)〕1)~3)。
OS と同様のランダム化第Ⅲ相試験が行われており,無増悪生存期間を統計学的に有意に延長すると報告されている〔OlympiAD 試験ではHR:0.53(95%CI:0.29-0.97),EMBRACA 試験ではHR:0.54(95%CI:0.41-0.71),BRAVO 試験ではHR:0.69(95%CI:0.46-1.02)〕。
無増悪生存期間,OS と同様に複数のランダム化比較試験から有害事象については報告されているが1)~5),日本人に限ったものはなく,アジア人でのサブグループ解析がなされており非直接性は低いと判断した。有害事象について一概にまとめることは難しいが,標準治療(化学療法)と比べて,Grade 3 以上の有害事象や,重篤な有害事象は増加していないため小さいと判断されたものの,PARP 阻害薬での治療群では,貧血,血球減少,悪心,嘔吐がみられた点には留意が必要である。
タラゾパリブを検討したEMBRACA 試験とveliparib と化学療法の併用を検討したBROCADE3 試験の2 つのランダム化比較試験で本アウトカムに関しては報告がなされていた7)~9)。EMBRACA 試験では,global health status(GHS)/QOL が,標準治療(化学療法)に比べて優っているという結果であったが,化学療法と併用したBROCADE3 試験ではQOL スコアは両群で変わらなかった。ランダム化比較試験での介入であり非直接性は低いと判断した。選択バイアスを考慮しバイアスリスクは中とした。非一貫性に関しては,エンドポイントの項目が報告によって異なりまたサンプル数が少なく非一貫性は高いと判断した。
1 編の観察研究によると,BRCA 遺伝学的検査に引き続くオラパリブ治療と化学療法単独による治療を比較した観察研究では,化学療法と比較して14,677,259 円/QALY の増加を認める10)。また,タラゾパリブでは0.22 QALY の増加がみられたが,タラゾパリブのコストが84,003 ユーロであるのに対して化学療法は12,741 ユーロであり費用対効果は低いと考えられたと報告されている事より11),比較対象がおそらく優位とされた。
これに対する研究報告はなく,システマティックレビューが実施できなかった。ただ,医療者にとっては,PARP 阻害薬投与は容認可能といえるが,当事者にとっては有害事象の種類や程度,経済的負担等が,治療の価値を判断するうえで重要と思われる。その点を考慮し,決定した。
EQ-5D(European Quality-of-Life 5-Dimensions) 5-Level を用いての後ろ向き研究は1 編のみであり,非直接性は中,バイアスリスクは高と判断した。1 編のみであり非一貫性に関しては評価が難しい。EQ-5D の平均値が,PARP 阻害薬での治療群では0.83,化学療法群では0.75 であり統計学的に有意にPARP 阻害薬群でスコアが良かった(P=0.04)。患者満足度に関して優位差はあるものの,後ろ向き研究であるため,一定のバイアスが存在する可能性があるため,重要な不確実性もしくはばらつきの可能性があると判断した12)。
BRCA1/2 病的バリアントを保持する転移再発乳癌患者という,希少な集団ではあるが,複数のランダム化比較試験が実施されており,無増悪生存期間の延長,有害事象の内容に関してはある程度エビデンスがあるものと考えられるが,希少な集団であるため,人種差や日本人コホートでの十分な比較はできていない。また重篤ではないものの,PARP 阻害薬における有害事象については注意する必要がある。
無増悪生存期間,患者の満足度が標準治療(化学療法)より高く,統計学的に有意ではないもののOSは延長傾向であり,QOL に関しては両群差がなかった。費用対効果に関しては対象群が有意であった。患者の満足度に関しては報告がない状況ではあったものの,総合的に益は大きいと判断した。
PARP 阻害薬での治療群では,貧血,血球減少,悪心,嘔吐がみられるものの,Grade 3 以上の有害事象や,重篤な有害事象は増加していないため,害は小さいとした。
本CQ の推奨決定会議参加対象委員12 名の内訳は,乳癌領域医師2 名,婦人科領域医師2 名,遺伝領域医師2 名,遺伝看護専門看護師1 名,認定遺伝カウンセラー2 名,患者・市民3 名であった。推奨決定会議の運営にあたっては,事前に資料を供覧し,参加対象委員全員がEvidence to Decision フレームワークを記入して意見を提示したうえで,当日の議論を行った。推奨決定会議には参加対象委員のうち,9 名が参加した。
システマティックレビューでは優先度に関するレポートはなかった。ただ,これまでの臨床試験の結果から,アンスラサイクリン系薬剤およびタキサン系薬剤既治療のHER2 陰性転移再発乳癌に対するPARP 阻害薬の投与によりOS 延長は認めないものの,無増悪生存期間延長が認められるため,優先事項と考えた。
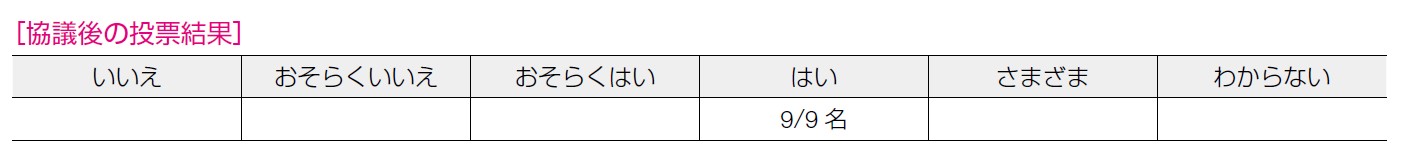
望ましい効果として,無増悪生存期間,OS,QOL,患者の意向,患者の満足度が検討された。ランダム化第Ⅲ相試験として,オラパリブを検討したOlympiAD 試験,タラゾパリブを検討したEMBRACA試験,ニラパリブを検討したBRAVO 試験について,複数の報告があり,無増悪生存期間を統計学的に有意に延長すると報告されている。〔OlympiAD 試験ではHR:0.53(95%CI:0.29-0.97)〕,EMBRACA 試験ではHR:0.54(95%CI:0.41-0.71),BRAVO 試験ではHR:0.69(95%CI:0.46-1.02)〕1)5)。無増悪生存期間と同様の複数のランダム化第Ⅲ相試験が行われているが,いずれもOS を延長する傾向はみられたが,統計学的に有意ではなかった〔OlympiAD 試験ではHR:0.98(95%CI:0.54-1.78),EMBRACA 試験ではHR:0.87(95%CI:0.67-1.073),BRAVO 試験ではHR:0.95(95%CI:0.63-1.42)〕2)~5)。タラゾパリブを検討したEMBRACA 試験では,GHS/QOL が,標準治療(化学療法)に比べて優っているという結果〔HR:0.365(95%CI:0.264-0.563)〕であった10)~12)。EQ-5D を用いての後ろ向き研究1 報のみであり,バイアスリスクは高いもののEQ-5D の平均値が,PARP 阻害薬での治療群では0.83,化学療法群では0.75 であり統計学的に有意にPARP 阻害薬群でスコアが良かった(P=0.04)13)。
望ましくない効果として,有害事象が検討された。OlympiAD 試験,EMBRACA 試験の2 つの第Ⅲ相比較試験からの結果では,オラパリブと化学療法の比較では,Grade 3 以上の有害事象の頻度はオラパリブ群で低かった(36.6% vs. 50.5%)が,タラゾパリブと化学療法の比較では,Grade 3 以上の血液毒性がタラゾパリブ群で高く(55% vs. 38%),非血液毒性に大きな差はなかった(32% vs. 38%)。有害事象について一概にまとめることは難しいが,標準治療(化学療法)と比べて,Grade 3 以上の有害事象や,重篤な有害事象は増加していないが,PARP 阻害薬での治療群では,貧血,血球減少,悪心,嘔吐がみられた1)~5)。2 つの試験において,PARP 阻害薬での治療群では,貧血,血球減少,悪心,嘔吐がみられるものの,Grade 3 以上の有害事象や,重篤な有害事象は増加していないため「小さい」とした。

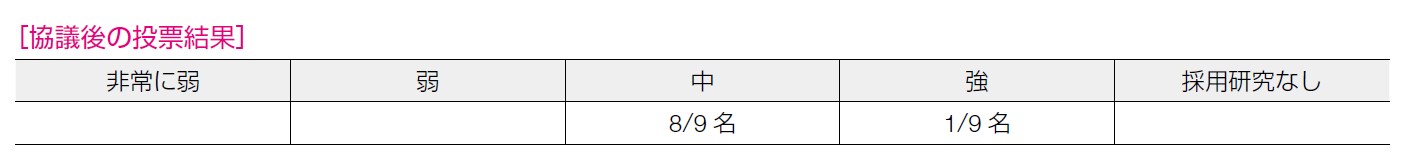
無増悪生存期間,OS,有害事象に関しては「強」であるが,対費用効果や患者の満足度が「非常に弱」であった。益のアウトカムに関するエビデンスは「強」と「弱」が混在しているものの,害のアウトカムに関するエビデンスが「強」であることから,総合的に「中」とした。
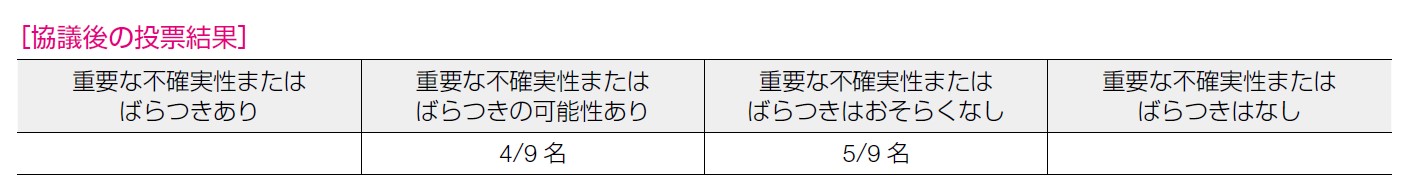
患者の満足度に関してはPARP 阻害薬での治療群では0.83,化学療法群では0.75 であり統計学的に有意にPARP 阻害薬群でスコアが良かった(P=0.04)13)。あげられた主要アウトカムは再発乳癌患者がPARP 阻害薬の使用を検討する際に重視されるものが網羅されていると思われ,意思決定においてその重要度の判断に大きなばらつきはないと考えた。
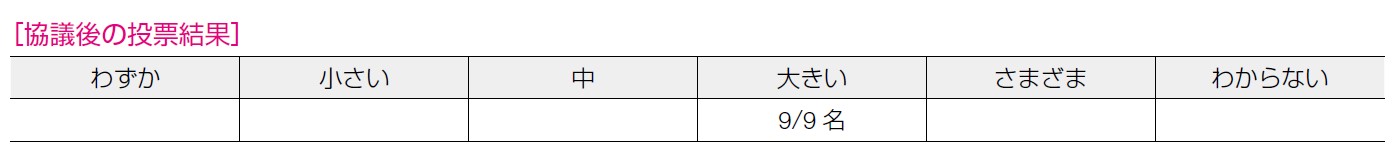
前述のとおり望ましい効果は「大きい」,望ましくない効果は「小さい」と判断したことや,OS の改善が明らかでないことから「おそらく介入が優位」とした。

1 編の観察研究によると,BRCA 遺伝学的検査に引き続くオラパリブ治療と化学療法単独による治療を比較した観察研究では,化学療法と比較して14,677,259 円/QALY の増加を認める。また,タラゾパリブでは0.22 QALY の増加がみられたが,タラゾパリブのコストが84,003 ユーロであるのに対して化学療法は12,741 ユーロであり費用対効果は低いと考えられたと報告されている。QALY に関して得られる効果に対して高コストであることから,「比較対象がおそらく優位」とした。

医療者にとっては,PARP 阻害薬投与は容認可能といえる。ただ,当事者にとっては有害事象の種類や程度,経済的負担等が治療の価値を判断するうえで重要と思われる。PARP 阻害薬を容認するかどうかについては,当事者の状況によって個々に変わると考える。その点を考慮し,「おそらくはい」とした。
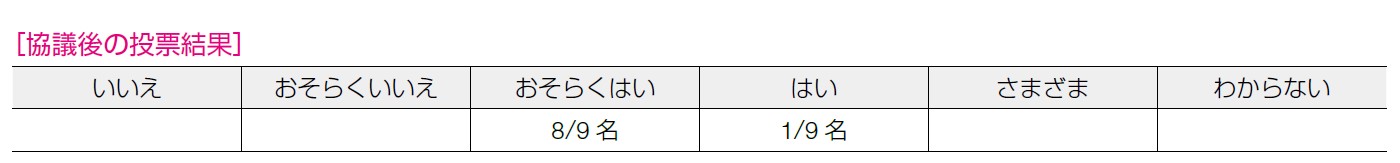
PARP 阻害薬(オラパリブおよびタラゾパリブ)自体は保険診療となり,どの医療機関でも実施可能であるが,患者選定を行うにあたっては遺伝カウンセリングやその後のフォローアップ体制が整っている施設との連携での実施が望ましい。そのため,HBOC 診療に精通した施設での患者選定と,有害事象対策も含めた治療を専門医のもとで行う必要性を鑑みて,「おそらくはい」とした。
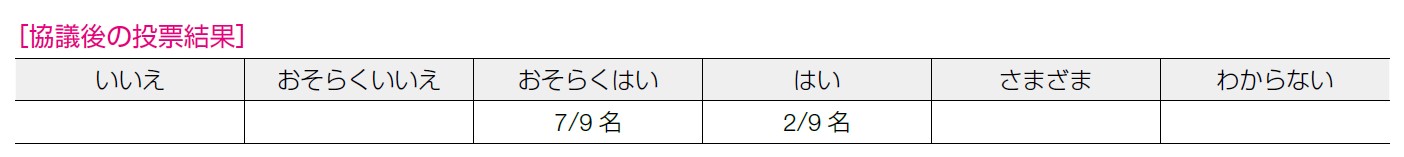
推奨決定会議では「当該介入の条件付きの推奨」とした理由として,アンスラサイクリン系薬剤およびタキサン系薬剤既治療のHER2 陰性乳癌のみの保険適用であること,生存期間延長のデータがないこと,対費用効果が明らかであること,転移再発乳癌では二次発がんのデータ不明ではあるものの他がん種では認められることがあげられた。

ASCO ガイドラインでは一~三次治療で化学療法の代替治療として強く推奨されている。プラチナ製剤との比較データはない14)(Type:evidence based;Evidence quality:high;Strength of recommendation:strong)。
NCCN ガイドラインでは優先レジメンとして掲載されている13)。
ESMO ガイドライン(2021 年版)ではPARP 阻害薬の適応検討のためBRCA1/2 病的バリアント検索が推奨されている[germline(LOE Ⅰ),tumour(incorporating germline and somatic)(LOE Ⅰ)and somatic(LOE Ⅰ/Ⅱ)](Level of agreement 1/4 100%;total agreement)15)。
オラパリブとタラゾパリブの2 剤の使い分けをどのようにするのかを検討していく必要性がある。
今回のシステマティックレビューの結果では,乳癌のOS に関する報告は統計学的有意差がなかった。また長期投与に伴う安全性も不明瞭であるため,この点に関してはさらなるモニタリングが必要と思われる。
外部評価では内容に関する大きな指摘はなかった。
BRCA,advanced breast cancer,drug treatment,poly ADP-ribose polymerase inhibitor,QOL,adverse event,cost,patient preference,patient satisfaction
文献検索式,エビデンス総体評価シート,システマティックレビューレポート,Evidence to Decisionフレームワークは,JOHBOC ホームページに掲載。
