Ⅱ-2 乳癌領域
BRCA1/2 病的バリアントを保持する再発高リスク乳癌患者に対し周術期(術後)薬物療法に,PARP 阻害薬の投与を条件付きで推奨する。
推奨のタイプ:当該介入の条件付きの推奨
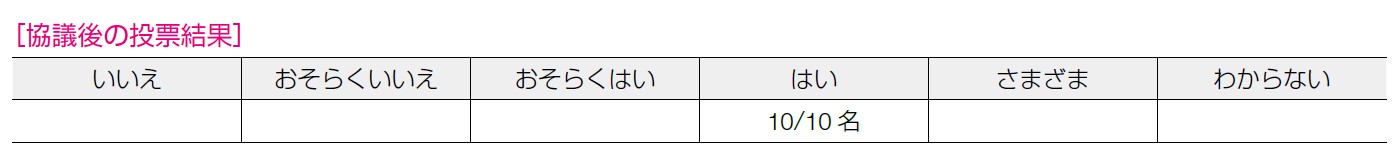
エビデンスの確実性:中,合意率:90%(9/10 名)
推奨の解説:HER2 陰性早期乳癌に対して,再発リスクが高い場合,周術期化学療法後にオラパリブを1年間術後投与することを強く推奨する。推奨決定会議では「当該介入の条件付きの推奨」とした理由として,アンスラサイクリン系薬剤およびタキサン系薬剤既治療のHER2 陰性・再発高リスクの乳癌のみを対象としていること,費用対効果は明らかではないこと,PARP 阻害薬による二次性悪性腫瘍発現が報告されていることが挙げられた。
実臨床ではBRCA1/2 病的バリアントを保持するHER2 陰性進行再発乳癌患者に対するPARP 阻害薬が無増悪生存期間の延長効果を示している。周術期治療においても同薬剤の使用によりBRCA1/2の生殖細胞系列変異を保持する早期乳癌患者でも同様の有効性を示す可能性があり,その検討が必要であると思われるため,BRCA1/2 病的バリアントを保持するHER2 陰性早期乳癌患者に対する術後PARP 阻害薬の意義を検討した。
本CQ ではPARP 阻害薬を含む治療群と含まない治療群の2群間で,「無浸潤疾患生存期間」「無再発増悪期間」「全生存期間(OS)」「有害事象」「費用対効果」「患者の意向」「患者の満足度」「病理学的完全奏効(pathological complete remission:pCR)率」を評価した。
本CQ に対する文献検索の結果,PubMed 63 編,Cochrane 31 編,医中誌6 編が抽出され,これにハンドサーチ1 編を加えた計101 編がスクリーニング対象となった。2名のシステマティックレビュー委員が独立して計2 回の文献スクリーニングを行い,抽出された9編がシステマティックレビューの対象となった。介入研究9編を採択した。無浸潤疾患生存期間,無再発増悪期間,OS,有害事象,費用対効果,患者の意向,患者の満足度,pCR に関して定性的なシステマティックレビューを行った。
BRCA1/2 病的バリアントを保持する早期乳癌患者に対する周術期薬物療法(術後)としてランダム化第Ⅲ相試験であるOlympiA 試験から中間解析結果が2編報告されている1)2)。OlympiA 試験は,術前または術後化学療法歴のあるBRCA1/2 病的バリアントを保持するHER2 陰性で再発高リスクの乳癌患者を対象として,術後薬物療法としてPARP 阻害薬であるオラパリブ1年間投与とプラセボ1年間投与を比較した第Ⅲ相試験である。本試験における再発高リスク患者とは,術前化学療法が行われた場合,TNBC ではnon-pCR(乳房および/または腋窩リンパ節に浸潤癌が残存),ホルモン受容体陽性乳癌ではnon-pCR かつclinical and pathological stage(CPS)and estrogen-receptor status and histologic grade(EG)スコア3 以上,術後化学療法が行われた場合,TNBC ではpT2 以上あるいはpN1以上,ホルモン受容体陽性乳癌では腋窩リンパ節転移4 つ以上とした。1,836 人がランダム化され,TNBC は1,509 人(82.2%),ホルモン受容体陽性乳癌は325 人(17.7%)であった。術前化学療法を受けたのは920 人(50.1%),術後化学療法を受けたのは916 人(49.9%)であり,1,720 人(93.7%)がアンスラサイクリンおよびタキサン系薬剤の両方の投与歴があった。追跡期間中央値3.5年時の4年無浸潤疾患生存期間はオラパリブ群82.7%,プラセボ群75.4%〔HR:0.63(95%CI:0.50-0.78)〕とオラパリブ群で有意な改善を認めた。
【エビデンスの確実性:強】
前述のOlympiA 試験では遠隔無病生存期間が報告されており,4年遠隔無病生存期間はオラパリブ群で86.5%,プラセボ群79.1%〔HR:0.61(95%CI:0.48-0.77)〕と,リスク差は7.4%であった2)。
この他,術前化学療法施行後のTNBC またはBRCA1/2 病的バリアント保持者を対象とした,シスプラチンとPARP 阻害薬であるrucaparib(本邦未承認)の併用について検証した探索的第Ⅱ相試験も報告されている3)。対象128 人のうち,シスプラチン群65 人,シスプラチン+rucaparib 併用群は63人で,22 人がHDR 関連遺伝子の病的バリアントを保持していた(BRCA1 8 人,BRCA2 12 人,BRIP2 2 人)。22 人の5年無再発増悪期間はシスプラチン群で34.6%,シスプラチン+rucaparib 併用群で43.8%となり,rucaparib 追加により有意な改善を示すことはできなかった(P =0.29)。
【エビデンスの確実性:中】
OlympiA 試験1)2)では,追跡期間3.5年時の4年OS はオラパリブ群89.8%,プラセボ群86.4%〔HR:0.68(95%CI:0.47-0.97,P =0.009)〕であり,OS についてもオラパリブ群で有意な改善を認めた。
OS については,OlympiA 試験の他にBrighTNess 試験4)でも報告されている。BrighTNess 試験では,TNBC 634 例をパクリタキセル,カルボプラチン,PARP 阻害薬であるveliparib(本邦未承認),あるいはパクリタキセル,カルボプラチン,あるいはパクリタキセルの3つの治療群に盲検的にランダムに割り付け,3週毎に4サイクル行い,その後ドキソルビシン+シクロホスファミド(AC)療法を2~3週毎に4サイクル追加して手術を施行している。主要評価項目はpCR で,パクリタキセル単独投与に比べveliparib の追加の有無にかかわらずカルボプラチンの上乗せ効果が認められた。さらに術後4年間の観察期間での結果が報告され5),副次評価項目である無イベント生存期間はパクリタキセル単独と比較して,パクリタキセル,カルボプラチン,veliparib 投与群で有意な延長を示した〔HR:0.63(95%CI:0.43-0.92,P=0.02)〕が,veliparib の追加効果はみられなかったが,サブグループ解析で,BRCA1/2 病的バリアント保持者ではpCR を得られた患者はnon-pCR であった患者と比較して有意に無イベント生存期間の延長を示している〔HR:0.14(95%CI:0.054-0.41,P<0.01)〕。OS については,パクリタキセル単独と比較しても,パクリタキセル,カルボプラチン,veliparib 群で有意な延長はみられなかった〔HR:1.25(95%CI:0.70-2.24,P= 0.46)〕。
【エビデンスの確実性:中】
OlympiA 試験1)2)では,貧血はオラパリブ群215 人(23.6%),プラセボ群35 人(3.9%)にみられ,Grade 3 以上の有害事象はオラパリブ群211 人(24.5%),プラセボ群102 人(11.3%)に生じた。オラパリブの減量はオラパリブ群228 人(25.0%),プラセボ群47 人(5.2%)でみられた。観察期間中央値3.5年で骨髄異形成症候群(myelodysplastic syndromes:MDS)/急性骨髄性白血病(acute myeloid leukemia:AML)の発生頻度はオラパリブ群2 人(0.2%),プラセボ群3 人(0.3%)であった。
【エビデンスの確実性:中】
採用研究はなかった。
【エビデンスの確実性:該当論文なし】
採用研究はなかった。
【エビデンスの確実性:該当論文なし】
患者満足度については,OlympiA 試験においてQOL 評価としてEORTC QLO-30 を用いて比較されている1)。オラパリブ群とプラセボ群ともに,内服期間12カ月を通してQOL 評価が低下することはなかった。
【エビデンスの確実性:弱】
pCR 率については前述のBrighTNess 試験での結果が報告されているが,BRCA1/2 病的バリアントの有無でpCR 率の改善はみられなかった〔OR:0.24(95%CI:0.04-1.24,P =0.09)〕6)。
この他,複数の第Ⅱ相試験が行われている。GeparOLA 試験はHER2 陰性早期乳癌106 人(このうちBRCA1/2 病的バリアント保持者は41 人)を対象とし,術前にパクリタキセルとオラパリブを12週投与し,その後AC療法を3週毎に4サイクル投与後に手術を行い,pCR 率を検証した探索的第Ⅱ相試験である7)。BRCA1/2 病的バリアント保持者におけるpCR(ypT0/is,ypN0)率は62.7%で,非保持者でのpCR 率41.3%と有意な改善を示した(P =0.047)。PETREMAC trial はStage Ⅱ/ⅢのTNBCにおいてER,PgR,HER2 とTP53 変異の有無により層別化し,術前オラパリブ単独投与を検証している第Ⅱ相試験である8)。
オラパリブ以外のPARP 阻害薬の術前投与については,タラゾパリブの探索的第Ⅱ相試験も報告があり9),BRCA1/2 病的バリアントを保持する1cm 以上のHER2 陰性乳癌患者を対象として,タラゾパリブを6カ月投与し,pCR 率は53%であった。ニラパリブのpilot study も報告されている10)。
いずれにおいても,BRCA1/2 病的バリアント保持者におけるPARP 阻害薬の術前投与によるpCR率改善のエビデンスはまだ不十分であり,今後のさらなる臨床試験の結果が期待される。
【エビデンスの確実性:弱】
以上よりBRCA1/2 病的バリアントを保持する乳癌患者に対する周術期薬物療法としてオラパリブの術後1年間投与による有効性が示された。術前PARP 阻害薬投与についても,今後の臨床試験の結果や薬剤開発が期待される。
BRCA1/2 病的バリアントを保持する乳癌患者に対する周術期薬物療法としてのPARP 阻害薬の有用性について,オラパリブによる無浸潤疾患生存期間およびOS の有意な改善を認めた。1編のランダム化比較試験のみであるが,BRCA1/2 病的バリアントのみを対象とした質の高い試験と考えられる。
害のアウトカムとして本CQ では有害事象が当てはまるが,PARP 阻害薬投与により貧血とGrade 3以上の有害事象が増加するものの,無浸潤疾患生存期間およびOS の有意な改善を認めており,益が害を上回ると考える。
本CQ の推奨決定会議参加対象委員12名の内訳は,乳癌領域医師2名,婦人科領域医師2名,遺伝領域医師2名,遺伝看護専門看護師1名,認定遺伝カウンセラー2名,患者・市民3名であった。推奨決定会議の運営にあたっては,事前に資料を供覧し,参加対象委員全員がEvidence to Decision フレームワークを記入して意見を提示したうえで,当日の議論を行った。推奨決定会議には参加対象委員のうち,10名が参加した。
優先度に関するレポートはなかったものの,これまでの臨床試験の結果から,アンスラサイクリン系薬剤およびタキサン系薬剤既治療のHER2 陰性転移再発乳癌に対するPARP 阻害薬の投与により無増悪生存期間の延長が認められることは明らかである。また周術期での使用により,OS の延長を認めている。そのため優先事項と考えた。
望ましい効果として「無浸潤疾患生存期間」「無再発増悪期間」「OS」「費用対効果」「患者の意向」「患者の満足度」「pCR 率」が検討された。ランダム化第Ⅲ相試験として,オラパリブを検討したOlympiA 試験では,無浸潤疾患生存期間はオラパリブ群82.7%,プラセボ群75.4%〔HR:0.63(95%CI:0.50-0.78)〕とオラパリブ群で有意な改善を認めた1)2)。無浸潤疾患生存期間と同様の複数のランダム化第Ⅲ相試験が行われているが,OlympiA 試験では遠隔無病生存期間が報告されており,4年遠隔無病生存期間はオラパリブ群で86.5%,プラセボ群79.1%〔HR:0.61(95%CI:0.48-0.77)〕と,リスク差は7.4%であった。また,追跡期間3.5年時の4年OS はオラパリブ群89.8%,プラセボ群86.4%〔HR:0.68(95%CI:0.47-0.97,P =0.009)〕であり,OS についてもオラパリブ群で有意な改善を認めた。QOL 評価としてEORTC QLO-30 を用いて比較されており,オラパリブ群とプラセボ群ともに,内服期間12カ月を通してQOL 評価が低下することはなかった1)。pCR 率についてはBrighTNess 試験での結果が報告されているが,BRCA1/2 病的バリアントの有無でpCR 率の改善はみられなかった〔OR:0.24(95%CI:0.04-1.24,P =0.09)〕6)。以上よりOS,無浸潤疾患生存期間,無再発増悪期間延長効果が認められることと,QOL 低下は認めなかった点より大きいと判断した。

望ましくない効果として,有害事象が検討された。OlympiA 試験では,貧血はオラパリブ群215 人(23.6%),プラセボ群35 人(3.9%)にみられ,Grade 3以上の有害事象はオラパリブ群211 人(24.5%),プラセボ群102 人(11.3%)に生じた。薬剤の減量はオラパリブ群228 人(25.0%),プラセボ群47 人(5.2%)でみられた。観察期間中央値3.5年でMDS/AML の発生頻度はオラパリブ群2 人(0.2%),プラセボ群3 人(0.3%)であった1)2)。OlympiA 試験において,PARP 阻害薬での治療群では,貧血の有害事象が多い傾向であった。またGrade 3以上の有害事象はPARP 阻害薬治療群で多い傾向であり,減量が必要となる症例も多い傾向であった。ただ,3.5年の観察期間中央値でのMDS/AML の発生頻度は増加していないため,「中」とした。

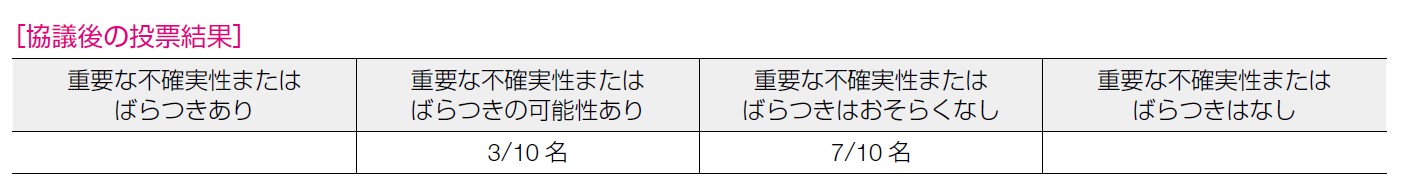
無浸潤疾患生存期間に関しては「強」であるが,無再発増悪期間,OS,有害事象は「中」であり,患者の満足度,pCR は「弱」であり,益のアウトカムに関するエビデンスは「強」と「弱」が混在しているものの,害のアウトカムに関するエビデンスが「中」であることから,益が害を上回ると判断し,総合的に「中」とした。

患者の満足度に関してはオラパリブ群とプラセボ群ともに,内服期間12カ月を通してQOL 評価が低下することはなかった1)。患者の満足度に関して単試験であることや,オラパリブ投与により有害事象の増加や薬剤費が高額になることから患者の希望にばらつきが出る可能性があるが,本CQ においては周術期薬物療法という立ち位置がポイントであると考えた。よって,患者の意思決定に相違はないと考え,「重要な不確実性またはばらつきはおそらくなし」とした。
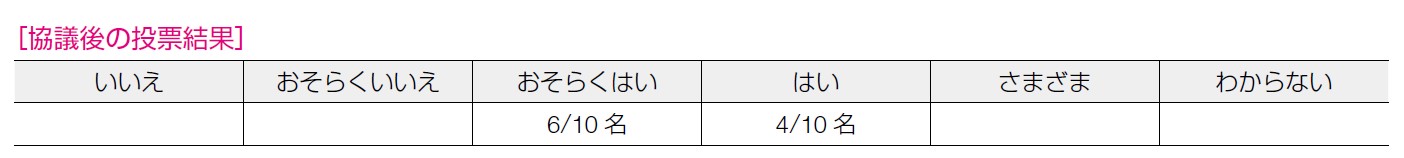
前述のとおり望ましい効果は「大きい」と,望ましくない効果は「中」と判断したため,「おそらく介入が優位」とした。

転移再発期における観察研究によると,BRCA 遺伝学的検査に引き続くオラパリブ治療と化学療法単独による治療を比較した観察研究では,化学療法と比較して14,677,259円/QALY の増加を認める。また,タラゾパリブでは0.22 QALY の増加がみられたが,タラゾパリブのコストが84,003ユーロであるのに対して化学療法は12,741ユーロであり,費用対効果は低いと考えられたと報告されている。転移再発期における観察研究では,QALY に関して得られる効果に対しては高コストだが,当該患者に関する費用対効果を検討した論文はないため「採用研究なし」とした。

医療者にとっては,PARP 阻害薬投与は容認可能といえる。ただ,当事者にとっては有害事象の種類や程度,経済的負担等が治療の価値を判断するうえで重要と思われる。PARP 阻害薬を容認するかどうかについては,当事者の状況によって個々に変わると考える。その点を考慮し,「おそらくはい」とした。
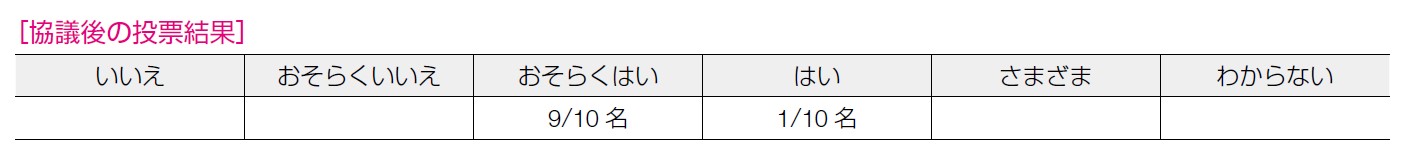
PARP 阻害薬(オラパリブ)自体は保険診療で投与できるが,HBOC 診療に精通した施設がまだ限られており,投与する際には連携医療機関と提携する必要がある点から「おそらくはい」とした。
費用負担や有害事象等について患者と情報を共有し,HBOC 診療やPARP 阻害薬による治療に精通した医療機関で投与することが必要であることや,薬剤費が高額なこと,二次発がんのデータがあることも患者に伝え,十分に理解してもらったうえで治療方針を決定する必要があるため,当該介入の条件付きの推奨となった。

ASCO ガイドライン11)では,再発リスクの高い早期HER2 陰性乳癌で,生殖細胞系列BRCA1 またはBRCA2 の病的バリアント保持者,あるいは病的バリアントの可能性が高い患者には,周術期化学療法と放射線療法を含む局所治療終了後に,1年間の術後のオラパリブ投与を行うべきであるとしている。
また,NCCN ガイドライン12)でも同様の記載がなされている。
PARP 阻害薬に対する安全性については,さらなる研究が必要と思われる。
今回のシステマティックレビューの結果では,周術期乳癌の無浸潤疾患生存期間,OS に関する報告で統計学的優位差を認めた。また長期投与に伴う重複がんに関する記載もなされているものの,長期投与に伴う安全性に関してはさらなるモニタリングが必要と思われる。
外部評価では内容に関する大きな指摘はなかった。
BRCA,breast neoplasms,adjuvant treatment,poly ADP-ribose polymerase inhibitor,adverse event,cost,patient preference,patient satisfaction
文献検索式,エビデンス総体評価シート,システマティックレビューレポート,Evidence to Decisionフレームワークは,JOHBOC ホームページに掲載。
