Ⅱ-2 乳癌領域
BRCA1/2病的バリアントを保持する乳癌患者に対し,CRRM を条件付きで推奨する。
推奨のタイプ:当該介入の条件付きの推奨
エビデンスの確実性:中,合意率:100%(12/12 名)
推奨の解説:本ガイドライン2021 年版1)で実施したメタ解析の結果から,BRCA1/2 病的バリアントを保持する乳癌患者におけるCRRM が対側乳房の乳癌発症リスクを低減させることは確実であることを示した。一方で生存率の改善効果に関しては,リスク低減卵管卵巣摘出術(RRSO)の影響を受けたエビデンスが多く,不確実性が依然として残る。CRRM を提案する際にはエビデンスの不確実性を考慮するとともに,価値観の多様性に配慮し,本人だけではなく家族も含めた協働意思決定が重要である。またCRRM の実施に際しては患者と医療者の協働意思決定が極めて重要であり,これらを実践できる遺伝カウンセリングを含む体制が十分に整っている施設で行うべきである。
BRCA1/2 病的バリアントを保持する乳癌患者において,対側乳癌発症リスクは乳癌の診断後20 年までにBRCA1 では40%,BRCA2 では26%と報告されている2)。これらの対象者の対側乳房に対する医学的介入の選択肢は,サーベイランスとCRRM である。卵巣癌は早期発見が難しく,適切なサーベイランスが確立されていないこともあり,欧米の各ガイドラインではリスク低減手術の推奨度が高い。一方,乳癌についてはサーベイランスが確立されているため,CRRM の実施について当事者にどのように説明し,意思決定をすることが適切であるかは難しい問題である。現在,わが国では保険診療として一定の施設基準を満たす医療機関においてCRRM が実施可能となってから約4 年が経過している。
本CQ ではCRRM 実施と非実施の2 群間で,「乳癌発症リスクの低減効果」「全生存率」「合併症」「費用対効果」「患者の意向」「患者の満足度」の6 項目をアウトカムとして設定して評価した。
本CQ に対する文献検索の結果,本ガイドライン2021 年版に加えて新たにPubMed 380 編,Cochrane 68 編,医中誌107 編が抽出され,計555 編がスクリーニング対象となった。2 名のシステマティックレビュー委員が独立して計2 回の文献スクリーニングを行い,抽出された15 編がシステマティックレビューの対象となった。
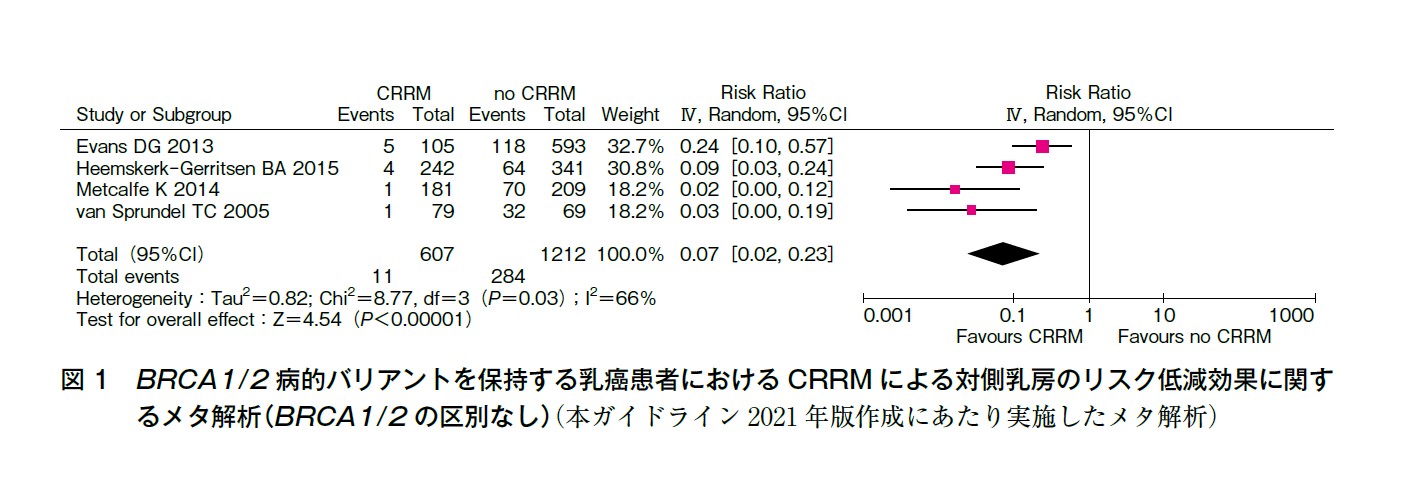
本ガイドライン2021 年版でのメタ解析により,対側乳癌発症については,RR:0.07(95%IC:0.02-0.23,P<0.00001)の結果となり,有意な対側乳癌発症リスクの低減効果を示した(図1)。しかし,統計学的異質性は中等度であることに注意が必要である(I2=66%)。またfunnel plot の分布からは出版バイアスの可能性も否定できない結果となった。Jia らが施行した4 研究でのメタ解析の結果も同様にCRRM により対側乳癌発症リスク低減効果が認められている〔RR:0.07(95%CI:0.02-0.13)〕が,I2=3%であり,統計学的な異質性は低い結果である3)。
いずれのメタ解析もRRSO の調整を行わずに解析を行っており,交絡因子としてRRSO の対側乳癌発症リスクの影響は除外できていないが,メタ解析で有意に対側乳癌発症リスクの減少を示していることから,エビデンスの確実性は強とした。 【エビデンスの確実性:強】
CRRM による全生存率の改善効果を報告した論文は今回新たな報告を加え,4編3)~6),効果なしとしたものが3編7)~9)であった。また,新規の報告として4 つの研究でのシステマティックレビューおよびメタ解析ではBRCA1/2 病的バリアントを保持する乳癌患者において,CRRM による全生存率の改善効果が示されている〔RR:1.15(95%CI:1.04-1.26)〕。I2=26%であり,統計学的な異質性は中等度であった3)。全生存率はあらゆる原因の死亡がイベントとして扱われるため,卵巣癌を発症している場合には乳癌以外のイベントにより全生存率が規定される可能性も十分に考慮する必要がある。
このような背景がある中で,ほとんどの研究でRRSO の交絡因子の調整がされていないことが全生存率について検討するうえで大きな問題となる。RRSO の調整をした研究では,全死亡率がCRRM+RRSO 群で7%とCRRM 群で12%であったが,統計学的有意性の検証は行われていない4)。このような理由から,エビデンスの確実性は中とした。 【エビデンスの確実性:中】
CRRM を乳癌手術と同時に施行した場合の術後minor 合併症はCRRM を施行しなかった場合と比較して増加するが,再手術率には差がないという報告もある10)。合併症のアウトカムはCRRM が直接的に起因する術後合併症(感染,疼痛,seroma 等の術後合併症,再手術率等)やQOL に関するもの(ボディイメージ,精神面への影響)等,研究毎に異なっており,非一貫性が非常に大きい。またアウトカム毎に調査する時期やフォローアップ期間にばらつきが大きく,評価の統一も困難である。加えてCRRM の選択は患者本人によるため,選択バイアス,実行バイアスが大きく,行われている術式についても乳房再建術の有無等も統一されていない。さらには今回の採用論文にはBRCA1/2 病的バリアントの有無が明らかではない対象を含むものが複数あり,以上の理由からエビデンスの確実性は非常に弱とした。 【エビデンスの確実性:非常に弱】
CRRM とサーベイランス群でのコストの比較検討では,その効果指標に増分費用効果比[incremental cost-effectiveness ratio:ICER〔1 質調整生存率(quality-adjusted life year:QALY)〕を改善するために必要となる追加費用]が用いられており,BRCA1/2 病的バリアント保持者ではCRRM の費用対効果の改善が認められている11)。また,Comprehensive Score for financial Toxicity(COST)を指標とするとCRRM はサーベイランス群と比較してfinancial toxicity を認めていない10)。しかしながら,わが国の医療制度と異なる環境下での検討であることから,この結果をわが国に外挿することはできない。以上の理由からエビデンスの確実性は非常に弱とした。【エビデンスの確実性:非常に弱】
わが国でCRRM が保険収載される前の意向調査では,対象者の22.5%が今後CRRM を受けたいという希望をもっていると報告されている12)。BRCA1/2 病的バリアントを保持する乳癌患者ではBRCA1 病的バリアント保持者はBRCA2 病的バリアント保持者よりもRRM 施行率が高かった〔BRCA1 15.4% vs. BRCA2 5.2%(P=0.001)〕13)。また,直近に乳癌の診断を受けた患者は乳癌既往の患者よりも乳房再建術を伴うRRM を希望する人が多かった(P=0.043)14)が,対象患者の中にはBRRM や再建症例も含まれている。保険収載後の意向調査はなく,エビデンスの確実性は非常に弱とした。【エビデンスの確実性:非常に弱】
採用された論文の多くはBRCA1/2 病的バリアントを保持しない対象や再建症例も含んでおり,サンプルサイズも小さい。評価基準がQOL,ボディイメージ,セクシャリティ等多岐にわたる。非直接性,バイアスリスク,非一貫性はいずれも大きくCRRM が患者満足度に与える影響について結論付けることは困難である。以上の理由からエビデンスの確実性は非常に弱とした。【エビデンスの確実性:非常に弱】
CRRM の乳癌発症リスクの低減効果に関しては,本ガイドライン2021 年版で施行したメタ解析および今回新たに加えた1 編のメタ解析の結果からも統計学的に有意にリスク低減効果が認められたが,RRSO の影響は除外できていないことには注意が必要である。全生存率改善効果を報告した論文は4 編あるが,一番の交絡因子となる卵巣癌の既往およびRRSO が調整できていないため,不確実性が残り今後さらなる検討が必要と考えられる。費用対効果に関しては,海外からCRRM についてサーベイランス群と比較した費用対効果の改善が報告されているが,わが国の保険収載下での調査はなく今後わが国でのデータの集積が求められる。患者の意向に関しても保険収載以前の報告であり,今後わが国でのデータの集積が求められる。患者満足度は評価項目が多岐にわたるため一貫したデータがなく結論付けることはできなかった。
合併症の有無や程度に関しては合併症のアウトカムおよび調査期間が論文毎に異なっており,一概に結論付けることができないと考え,エビデンスの確実性は非常に弱としている。
本CQ の推奨決定会議参加対象委員12 名の内訳は,乳癌領域医師2 名,婦人科領域医師2 名,遺伝領域医師2 名,遺伝看護専門看護師1 名,認定遺伝カウンセラー2 名,患者・市民3 名であった。推奨決定会議の運営にあたっては,事前に資料を供覧し,参加対象委員全員がEvidence to Decision フレームワークを記入して意見を提示したうえで,当日の議論を行った。推奨決定会議には参加対象委員全員が参加した。
保険診療でCRRM が実施可能となり,日常診療でも実施件数が増加しているため,医療者目線および患者目線からも本CQ の優先度は高いと考えている委員がほとんどであった。一方で,乳癌を発症している年齢等も考慮すると対象は一律同じ条件とは言い難いという認識も共有された。また当事者である委員からは,医療者の適切なサポートは必須であり,常にアップデートした情報提供をして欲しいという意見も出された。
この検討事項では介入の望ましい効果の大きさについての評価が分かれ,活発な議論が行われた。その大きな理由として,新規乳癌発症のリスク低減効果は確実であるが,生命予後の改善まで明らかにされていない点で「中」と少し控えた評価とする意見があげられた。さらにRRSO の交絡因子の影響も排除しきれない点も重要視された。議論の中ではRRSO を行わずRRM のみを行う対象者は多くはないことから,純粋にRRM の効果を評価することは今後も難しいという意見も複数出た。このような状況では今後も介入の望ましい効果がさらに強くなることはないであろうことが予想される。当事者からは,患者の立場から考えると新規発症予防効果があることはそれだけで意義が大きいことであり,生存率の改善効果を重視しがちな医療者と視点の違いがあることについて指摘もあった。

介入の望ましくない効果として手術侵襲や合併症を論じることになるが,これらについてどの程度重きを置くかは個人間で差が生じることは避けられないという認識が委員の中で共有されていた。また乳癌を切除することによる合併症ではなく,発症リスクを回避するための手術に対する合併症のため,当事者の心理的葛藤は大きく,個人的な考え方に左右される可能性があるという重要な点も当事者から指摘された。

ここではほとんどの委員からRRSO の影響が排除されないことが最大の問題点としてあげられた。そしてRRSO を行わずRRM のみを行う対象者が少ないことが予想されるため,この影響は今後も排除しきれないバイアスとなるであろうことから,投票では全員一致して「中」の評価となった。

推奨決定会議ではすべての委員が「ばらつきの可能性あり」,または「ばらつきあり」に投票した。患者の価値観は多様性が非常に大きく,ばらつきは排除できないという意見が多かった。さらにはCRRM を実施した人,実施しなかった人,両者の考えも様々であろうことを考えても,論文から得られる知見だけで結論付けることはできないという指摘があった。また当事者からは,手術した後の価値観の調査が現時点では欠如しているため,今後の課題として重要であるという指摘もあった。
CRRM のもたらす対側乳癌の発症予防効果は非常に固いエビデンスがあるため,優位性についてはほとんどの委員で共有ができていた。一方,望ましくない効果に関するエビデンスの不確実性が高いという認識もほぼ一致した。ここで考えるべき「バランス」は望ましくない効果の大きさに依存するため,ほとんどの委員は「おそらく」という条件を付けることとなった。

「費用対効果」についての議論の難しさが直接反映され,様々な意見が活発に交わされた。わが国の医療事情,保険制度に即した費用対効果の研究がほとんどない現状では費用対効果の結論は出せないという考え方があった。一方,海外のデータを参考に推測することにも意味があるという考え方も会議の中で共有された。また費用対効果の考え方には個人に関する効果だけではなく,社会全体として予防にかける費用,治療にかかる費用,乳癌によって亡くなった際の社会的損失等のバランスを考える医療経済全体を見通した効果もとても重要な視点であることが改めて認識された。

委員の間では容認性はあるという方向性で概ね見解は一致していたが,CRRM の実施については患者背景の違い,個人の考え方のバリエーション等が内在するため,「おそらくはい」を選んだ委員が多かった。
この検討事項は委員全員で意見が一致した。現在,わが国ではHBOC 診療に必要な体制(乳腺外科,形成外科,婦人科,遺伝診療部門)が十分に整っている施設のもとでCRRM は実施可能となっている。しかし,これらの体制がすべての施設で整備できているわけではないため,「おそらく」を付けて実行可能性を評価した。
CRRM の対側乳癌発症予防効果の確実性,生命予後改善効果の不確実性を委員全員が認識したうえで意見が交わされた。本ガイドライン2021 年版が発刊されて以降,推奨タイプに影響を与えるだけの新たなデータに乏しく,また依然としてCRRM を行うことが推奨される患者群の特定ができない現状を踏まえると,「条件付き」の推奨が妥当であろうという方向性には異論がなかった。そして,ガイドラインを利用する患者や医療者のことを想定した場合,「推奨」という言葉の独り歩きがないように推奨文やその解説に配慮しなければならないという非常に重要な点も指摘された。

乳癌診療ガイドライン15)では,CRRM を弱く推奨すると記載されている。表現方法に違いはあるものの,記載内容としては本ガイドラインと齟齬はないと考える。
NCCN のガイドライン16)では,RRM の利点と欠点を含めたカウンセリングが重要で,当事者と十分に話し合ってRRM の実施について決定するべきであるとされている。ASCO のガイドライン17)では,予後改善効果はエビデンスが不十分ながら,診断時年齢,乳癌家族歴,罹患した乳癌や他癌の予後,MRI が受けられるかどうか,併存疾患,平均余命といったCRRM を考慮する因子を示している。ESMO*のガイドライン18)ではRRM のメリットは30 歳以降で実施するとその恩恵が最も大きくなるが,55 歳を超えるとそのエビデンスは弱くなると記載している。しかし,最終的にはRRM の実施は患者の意向によって決定されていると示している。いずれのガイドラインにおいてもBRCA1/2 病的バリアントを保持しない乳癌患者に比較して乳癌発症リスクが高いことを踏まえた十分な説明をしたうえで,考慮し得る選択肢であり,どのようなことに配慮しながらRRM を提案するのか言及している。
ESMO:European Society for Medical Oncology
わが国からのデータが最も望まれる研究の1 つに費用対効果があげられる。特にわが国のデータのみを用いた医療事情に側した費用対効果の情報は,今後CRRM が選択肢となる乳癌患者にとって重要な協働意思決定材料になり得る。
2020 年4 月以降保険診療として実施が可能になり,わが国でもCRRM を受けた乳癌患者の登録が蓄積されつつある。一方,本ガイドラインの作成過程で不足している情報は多々あることを共有した。例えば,CRRM を受けた人,受けなかった人が自分の決断に対してその後どのように考えているのか,あるいはCRRM の至適実施年齢等の情報があげられた。本ガイドライン2021 年版同様にCRRM後の予後についてのモニタリングは重要である。
外部評価団体より本文中の表現に関する指摘を受け,当該箇所を修正した。
BRCA,breast neoplasms,contralateral risk reducing mastectomy,complication,cost,patient preference,patient satisfaction
文献検索式,エビデンス総体評価シート,システマティックレビューレポート,Evidence to Decisionフレームワークは,JOHBOC ホームページに掲載。
